HOKUTO編集部
8ヶ月前
HER2陽性胃癌-実臨床におけるエビデンスと将来の展望① : 総論
HER2陽性胃癌に関する最新の試験結果や治療について専門医の視点から解説する新シリーズです。 ぜひ臨床でご活用ください (解説医師 : 国立がん研究センター中央病院頭頸部・食道内科/消化管内科 山本駿先生)。
解説医師

はじめに
切除不能な進行胃癌の治療戦略は以前に比して多様化しており、 現在では治療開始前にHER2、 CLDN18.2、 PD-L1 CPS、 MSIといったバイオマーカーを可能な限り評価した上で、 治療戦略を個別に検討している。 HER2はその中でも草分け的な存在であり、 切除不能な進行胃癌の約20%を占めるHER2陽性集団では、 ToGA試験¹⁾以降HER2を標的にした治療開発が行われてきた。
本稿では、 現在実臨床で用いられている分子標的薬トラスツズマブと、 抗体薬物複合体トラスツズマブ デルクステカン (T-Dxd) の承認のきっかけとなったToGA試験とDESTINY-Gastric01試験²⁾に加えて、 先日の欧州臨床腫瘍学会 (ESMO 2024) で発表されたKEYNOTE-811試験³⁾とDESTINY-Gastric03試験⁴⁾について概説する。
ToGA : 1次治療での3剤併用療法が標準に
未治療進行胃・食道胃接合部癌へのT-mab上乗せを検証
ToGA試験は、 未治療のHER2陽性の進行胃癌または食道胃接合部癌を対象に、 当時標準治療であった2剤併用化学療法へのトラスツズマブの上乗せ効果を検証した国際共同第Ⅲ相試験である。 ToGA試験におけるHER2陽性はHER2蛋白の過剰発現またはHER2遺伝子の増幅を認める症例と定義されていた。
ToGA試験には、 594例が登録され(試験治療群 : 298例、 対照群 : 296例)、 患者背景は両群で同様だった。
OS中央値でT-mab上乗せの優越性を証明
主要評価項目である全生存期間 (OS) 中央値に関しては、 試験治療群で13.8ヵ月、 対照群で11.1ヵ月と報告され、 トラスツズマブの上乗せの優越性が証明された (HR 0.74、 95%CI 0.60~0.91)。
探索的な解析において、 現在のHER2陽性の対象 (HER2 3+、 またはHER2 2+かつFISH陽性) では、 HR 0.65 (同0.51~0.83) と良好な結果であったが、 HER2 IHC 0/1+かつFISH陽性では、 HR 1.07 (同0.70~1.62) と有効性が減弱する傾向が見られた。
心毒性の発現頻度に明確な差なし
なお懸念されていた心毒性に関しては、 全gradeの発現頻度は、 試験治療群で6%、 対照群で6%と、 明らかな差を認めなかった。
この試験結果から、 現在HER2陽性の進行胃癌または食道胃接合部癌の標準的な1次治療として、 トラスツズマブとフッ化ピリミジン系薬剤、 プラチナ系薬剤で構成される3剤併用療法が確立した。
DG-01 : T-Dxdが3次治療で標準に
進行胃・食道胃接合部癌へのT-Dxdの有効性を検討
DESTINY-Gastric01試験は、 既治療のHER2陽性の進行胃癌または食道胃接合部癌を対象に、 殺細胞性抗癌薬単剤とT-Dxdを直接比較した無作為化第Ⅱ相試験である。 なおDESTINY-Gastric01試験におけるHER2陽性はHER2 3+、 またはHER2 2+かつFISH陽性と定義された。
DESTINY-Gastric01試験には、 187例が登録され(試験治療群 : 125例、 対照群 : 62例)、 患者背景は両群で同様だった。
ORR・OSともにT-Dxdの優越性を証明
主要評価項目である奏効割合 (ORR) に関しては、 試験治療群で51%、 対照群で14%と両群で有意差を認めた(p<0.001)。 また副次評価項目であるOS中央値に関しては、 試験治療群で12.5ヵ月であり、 対照群の8.4ヵ月に比して優越性が証明された(HR 0.59、 95%CI 0.39~0.88)。
肺毒性は試験治療群の1割に発現
なお懸念されていた肺毒性に関しては、 試験治療群で10%に報告され、 Grade 5の肺臓炎も1例報告された。
この試験結果から、 現在HER2陽性の進行胃癌または食道胃接合部癌の3次治療における標準治療として、 T-Dxdが確立された。 ただし肺臓炎に関する注意が必要であり、 実臨床においては、 診察時等に酸素化やレントゲン検査等、 肺臓炎の早期発見に注力する必要がある。
KN-811 : ICI含めた4剤併用が1次治療の標準に
3剤併用療法へのPem上乗せを検証
KEYNOTE-811試験は、 未治療のHER2陽性の進行胃癌または食道胃接合部癌を対象に、 ToGA試験で確立した3剤併用療法に、 免疫チェックポイント阻害薬 (ICI) であるペムブロリズマブの上乗せ効果を検証した国際共同第Ⅲ相試験である。
KEYNOTE-811試験には、 全体で698例が無作為化され(試験治療群 : 350例、 プラセボ群 : 348例)、 患者背景は両群で同様であった。
OSにおいてPem上乗せの優越性を証明
主要評価項目の一つであるOS中央値は、 試験治療群で20.0ヵ月、 プラセボ群で16.8ヵ月と、 ペムブロリズマブの上乗せの優越性が証明された (HR 0.80、 95%CI 0.67~0.94)。 また欧米で承認されているPD-L1 CPS1以上の集団においては、 OS中央値が試験治療群で20.1ヵ月、 プラセボ群で15.7ヵ月と良好な傾向が報告された (HR 0.79、 95%CI 0.66~0.95)。
Grade 3~4のAEは試験治療群で高い傾向
Grade 3~4の治療関連有害事象は、 試験治療群で58%、 プラセボ群で50%と若干、 試験治療群で高い傾向にあった。
この試験結果から、 今後HER2陽性の進行胃癌または食道胃接合部癌の標準的な1次治療として、 ペムブロリズマブとトラスツズマブ、 フッ化ピリミジン系薬剤、 プラチナ系薬剤で構成される4剤併用療法が用いられると考えられる。
DG-03 : 1次治療のT-Dxdは併用が有望か
進行胃・食道胃接合部癌へのT-Dxd単剤・併用療法を比較
DESTINY-Gastric03試験は、 未治療のHER2陽性の進行胃癌または食道胃接合部癌を対象に、 有望なT-Dxdを含む1次治療を検討した第Ⅰb/Ⅱ相試験である。
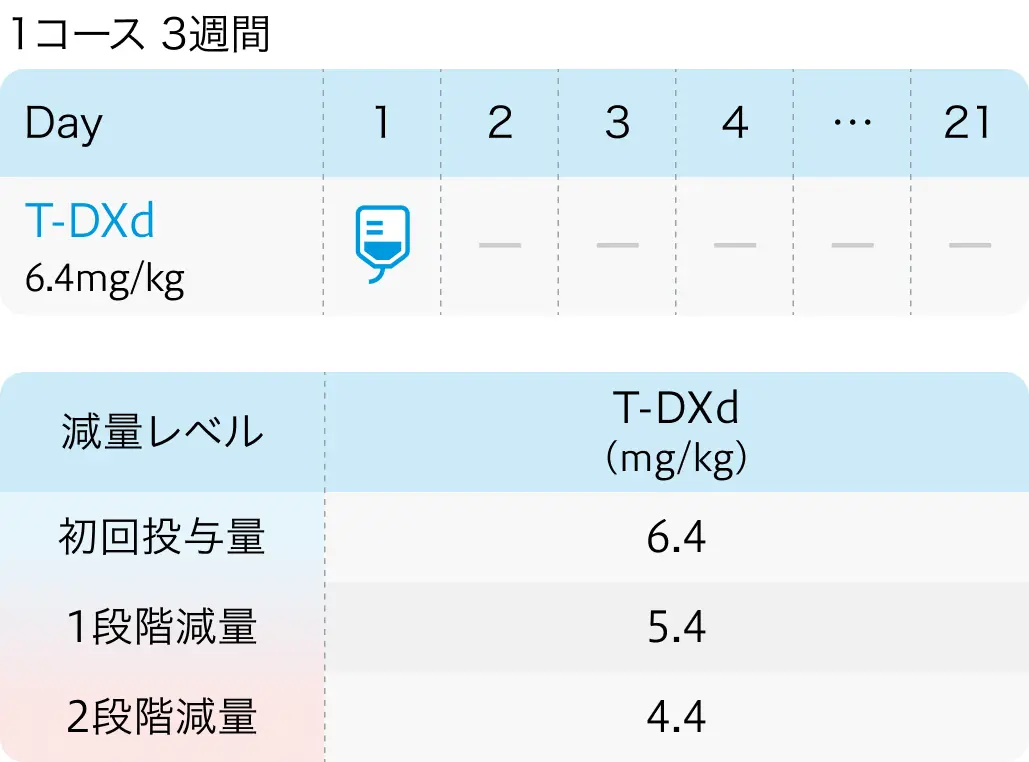
DESTINY-Gastric03試験では、 6つの治療群が設定され、 ①T-Dxd単剤群、 ②T-Dxd+5-FU群(T-Dxd+フルオロウラシル)、 ③T-Dxd 6.4mg/kg+FP+Pem群 (T-Dxd 6.4mg/kg+フッ化ピリミジン系薬剤+ペムブロリズマブ)、 ④T-Dxd+Pem群(T-Dxd+ペムブロリズマブ)、 ⑤T-Dxd 5.4mg/kg+FP+Pem群 (T-Dxd 5.4mg/kg+フッ化ピリミジン系薬剤+ペムブロリズマブ)、 ⑥標準治療群 (トラスツズマブ+フッ化ピリミジン系薬剤+プラチナ系薬剤) ――の有効性と安全性が検討された。
単剤より併用のほうが有望な可能性
本試験の結果は以下の通りであった。
▼ORR (Part 2における主要評価項目)
- T-Dxd単剤群 : 49%
- T-Dxd+5-FU群 : 78%
- T-Dxd 6.4mg/kg+FP+Pem群 : 58%
- T-Dxd+Pem群 : 63%
- T-Dxd 5.4mg/kg+FP+Pem群 : 59%
- 標準治療群 : 76%
▼無増悪生存期間 (PFS) 中央値
- T-Dxd単剤群 : 9ヵ月
- T-Dxd+5-FU群 : 20ヵ月
- T-Dxd 6.4mg/kg+FP+Pem群 : 10ヵ月
- T-Dxd+Pem群 : 8ヵ月
- T-Dxd 5.4mg/kg+FP+Pem群 : 未報告
- 標準治療群 : 12ヵ月
▼OS中央値
- T-Dxd単剤群 : 18ヵ月
- T-Dxd+5-FU群 : 23ヵ月
- T-Dxd 6.4mg/kg+FP+Pem群 : 23ヵ月
- T-Dxd+Pem群 : 16ヵ月
- T-Dxd 5.4mg/kg+FP+Pem群 : 未報告
- 標準治療群 : 18ヵ月
▼Grade 3以上の有害事象の発生割合
- T-Dxd単剤群 : 64%
- T-Dxd+5-FU群 : 76%
- T-Dxd 6.4mg/kg+FP+Pem群 : 91%
- T-Dxd+Pem群 : 80%
- T-Dxd 5.4mg/kg+FP+Pem群 : 34%
- 標準治療群 : 59%
まだT-Dxd 5.4mg/kg併用群の結果が不明であるが、 単剤よりは併用のほうが有望な印象であり、 あとは有害事象と効果のバランスが重要と考える。
おわりに
本稿では、 まずHER2陽性胃癌にまつわるピボタル試験の概説と今後重要になり得る研究の概説を行った。 次回以降では、 より詳細に実臨床における抗HER2療法について安全性も含めて取り上げる予定である。
出典
- Lancet. 2010 Aug 28;376(9742):687-697.
- N Engl J Med. 2020 Jun 18;382(25):2419-2430.
- N Engl J Med. 2024 Sep
- Ann Oncol. 2024 Sep. 35 Suppl 2S878
関連コンテンツ
臨床試験データベース : ToGA試験
未治療胃癌へのT-mab+Chemo+Pemで死亡リスク20%低減
ESMO2024レポート : KN-811 OS最終解析
解説医師 : 山本駿先生
解説医師 : 山本駿先生
解説医師 : 中山厳馬先生
関連レジメン
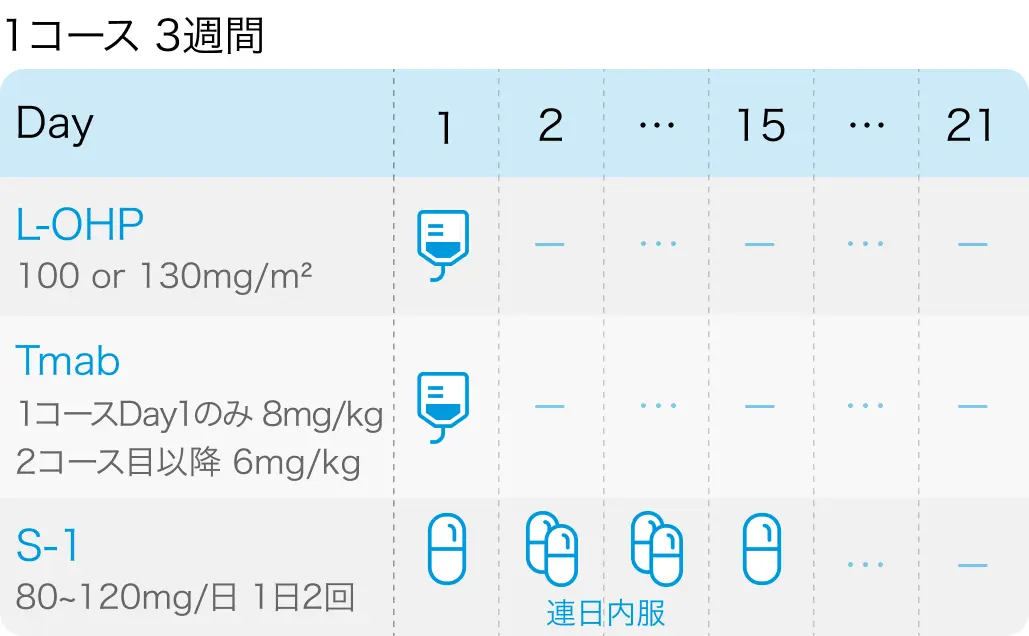
S-1 + オキサリプラチン + トラスツズマブ
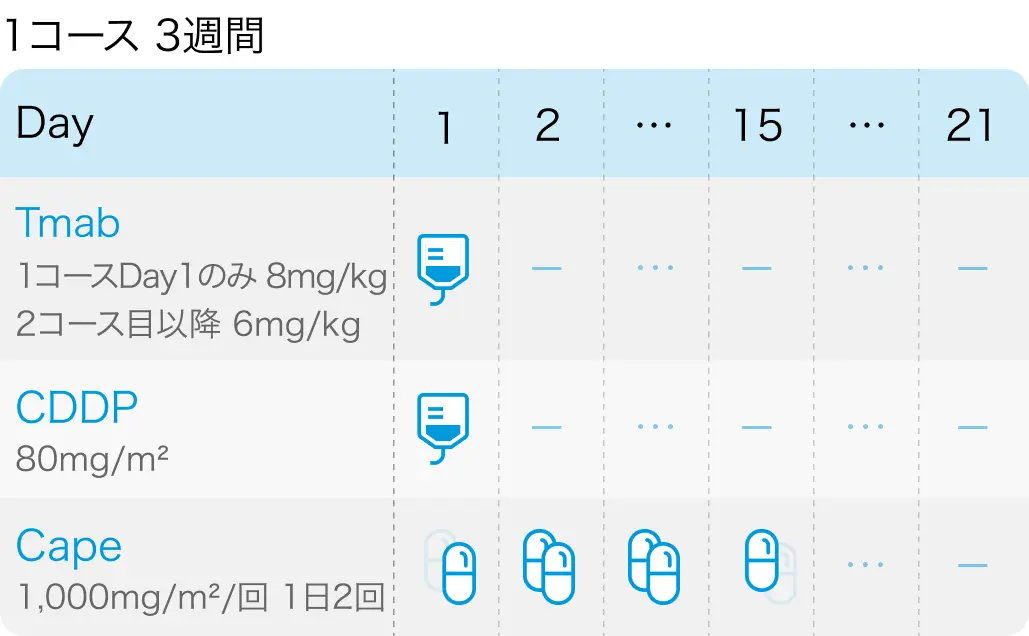
シスプラチン + カペシタビン + トラスツズマブ
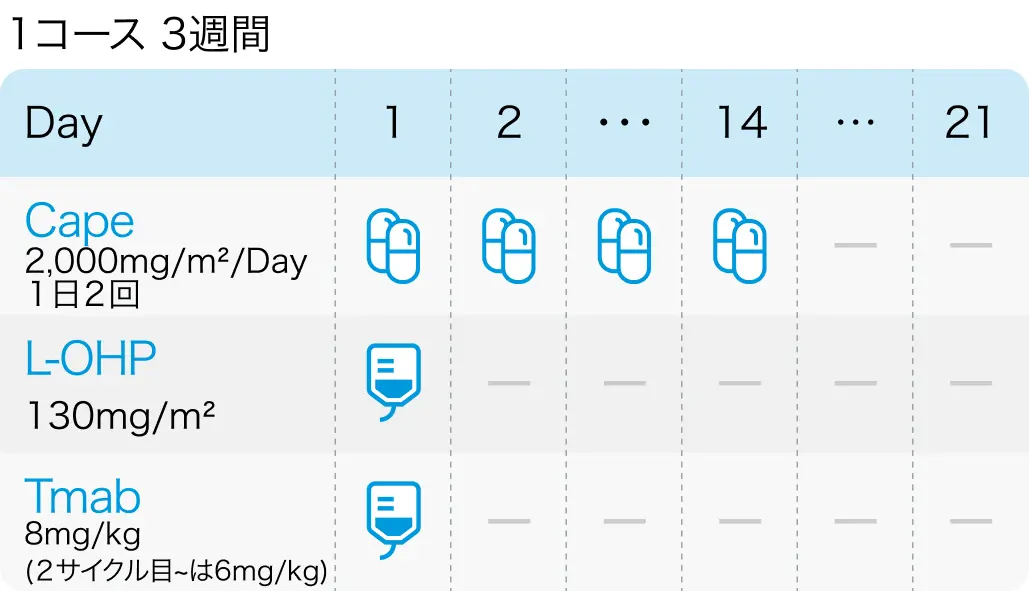
カペシタビン + オキサリプラチン + トラスツズマブ
S-1+シスプラチン+トラスツズマブ
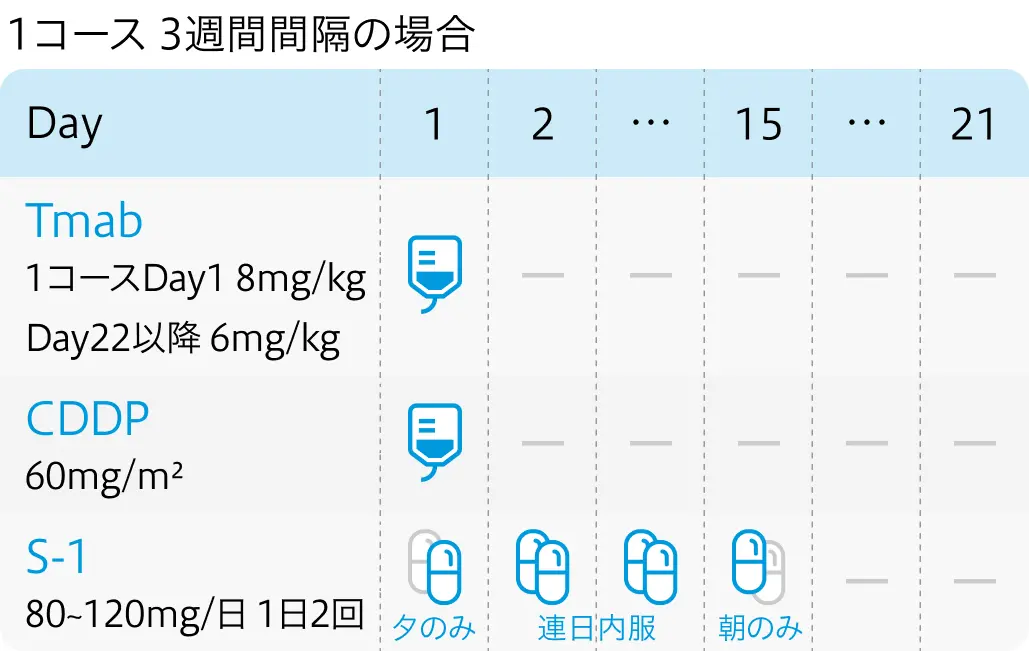
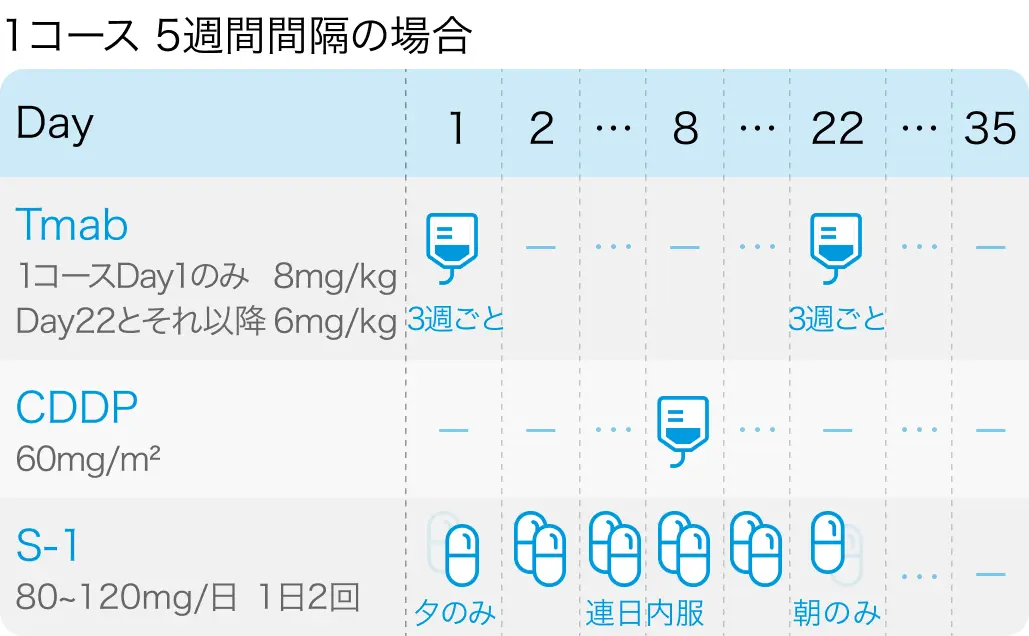
S-1+シスプラチン+トラスツズマブ
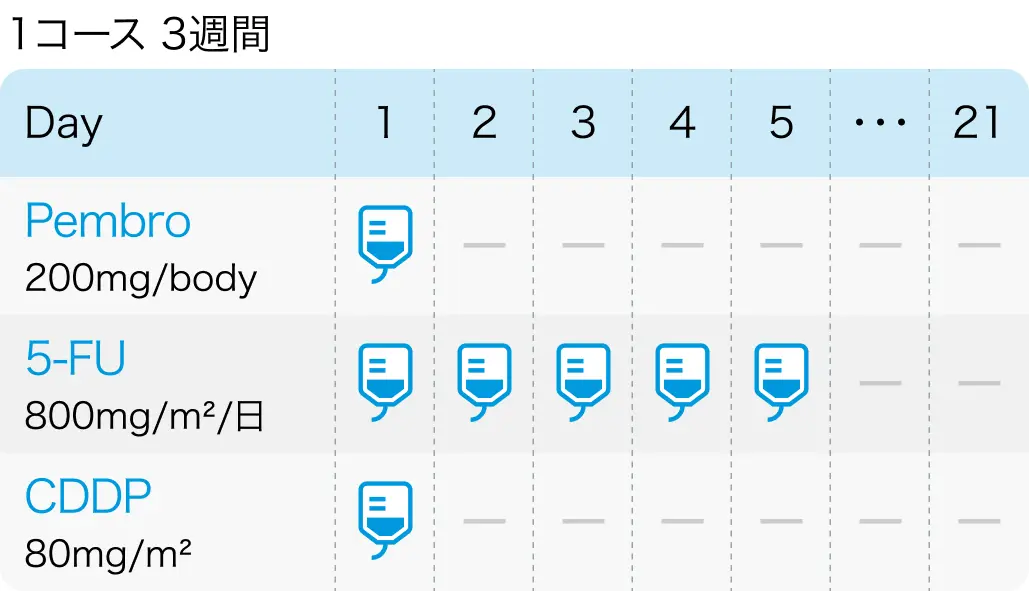
フルオロウラシル + シスプラチン + ペムブロリズマブ
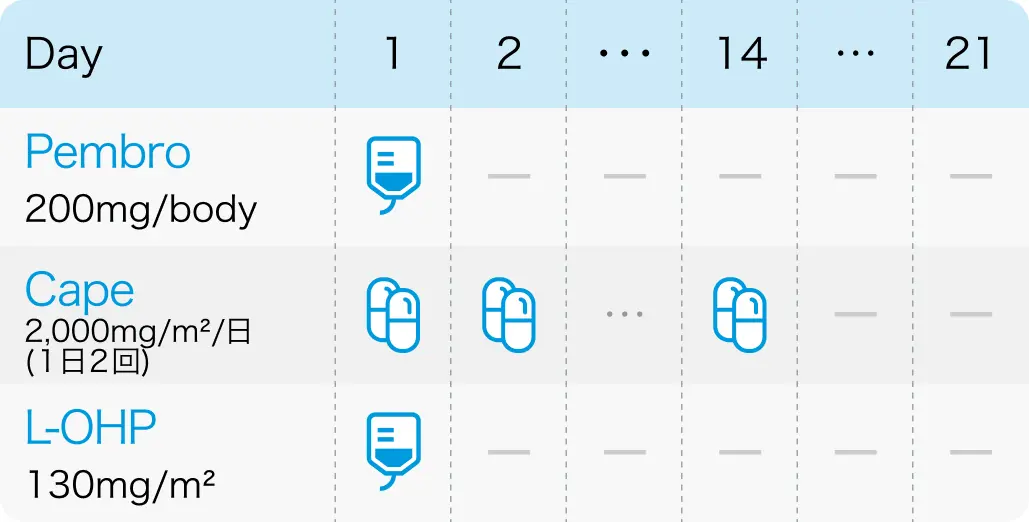
ペムブロリズマブ + カペシタビン + オキサリプラチン
トラスツズマブ デルクステカン
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。