Beyond the Evidence
2年前
【解説】切除不能大腸癌におけるHER2検査を提出するタイミングは?
「Beyond the Evidence」 では、 消化器専門医として判断に迷うことの多い臨床課題を深掘りし、 さまざまなエビデンスや経験を基に、 より最適な解決策を探求することを目指す企画です。 気鋭の専門家による充実した解説、 是非参考としてください。
Clinical Question
切除不能大腸癌におけるHER2検査を提出するタイミングは?
専門医の解説 「私はこう考える」

TRIUMPH試験の結果から化学療法歴のあるHER2陽性切除不能進行・再発大腸癌においては、 ペルツズマブ+トラスツズマブ療法が有力な治療選択肢となっている。 しかしHER2陽性大腸癌は約2~3%と希少であり、 その恩恵を得られる対象は限られている。 またRAS変異症例においてはこの治療の安全性と有効性が確立しておらず、 この試験の対象外となっている。 TRIUMPH試験においては奏効割合が約30%と高い効果が報告されており、 現在もHER2陽性大腸癌を対象に1次治療を含めて、 複数のHER2治療薬の開発が進んでいる。 1次治療開始前にRAS/BRAF遺伝子検査およびMSI検査とともにHER2検査を行うことが望ましいと考える。
HER陽性大腸癌の疫学
HER2陽性大腸癌の頻度は全体の2~3%程度、 KRAS/NRAS/BRAF野生型に限定するとその頻度は6~10%程度に上昇すると報告されているが、 その対象は比較的希少である。
臨床的な特徴
HER2陽性大腸癌の臨床的な特徴としてはRAS/BRAF遺伝子野生型が多く、 左側に多いとされ、 肺転移や脳転移を来しやすいと報告されている。 抗EGFR抗体薬に対する抵抗性を示すことが知られており、 この対象に対してはHER2標的薬を中心として治療開発が行われている。
HER標的薬による試験
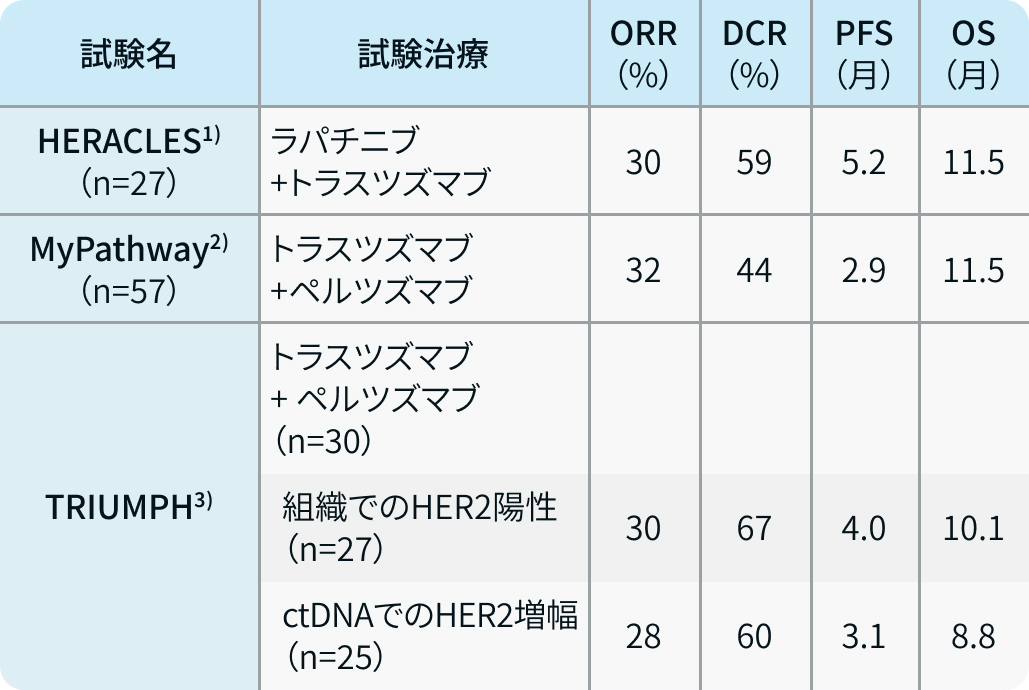
HERACLES試験
HERACLES試験¹⁾は標準治療終了後のHER2陽性切除不能進行・再発大腸癌患者を対象に実施された単群第Ⅱ相試験で、 ラパチニブとトラスツズマブによるHER2の二重阻害の有効性と安全性を検討している。
この試験においては奏効割合が30%、 無増悪生存期間 (PFS) 中央値が5.2ヵ月であった。
MyPathway試験
その後、 バスケット試験であるMyPathway試験²⁾において、 HER2陽性切除不能進行・再発大腸癌患者でのトラスツズマブ+ペルツズマブ併用療法の結果が報告された。
この試験では、 奏効割合が32%、 PFS中央値が2.9ヵ月と報告されていた。 いずれの試験においても治療関連死亡はなく、 重篤な有害事象は輸注関連反応程度であった。
TRIUMPH試験
TRIUMPH試験³⁾は本邦で行われた、 国内多施設共同第Ⅱ相医師主導治験で、 フッ化ピリミジン、 イリノテカン、 オキサリプラチンおよび抗EGFR抗体薬に不応もしくは不耐となったRAS遺伝子野生型かつHER陽性の切除不能進行・再発大腸癌を対象に対して、ペルツズマブ+トラスツズマブ併用療法の有効性と安全性が評価された試験である。
この試験においては、HER2陽性が①腫瘍組織の免疫組織化学染色(IHC)でHER2 3+または fluorescence in situ hybridization(FISH)陽性、 もしくは②血液検体でのcirculating tumor DNA(ctDNA)を用いたnext generation sequencingでHER2増幅かつRAS遺伝子変異野生型と定義されていた。 本試験においては30例が登録され、 主要評価項目である奏効割合は腫瘍組織で29.6%、 血液検体で28.0%であった。 PFS中央値においてもそれぞれ4.0ヵ月、3.1ヵ月の結果であった。 主な有害事象は輸注関連反応、 下痢、 食欲低下、 悪心、 口内炎であった。
こうした結果を踏まえ、 ペルツズマブおよびトラスツズマブの併用療法が2022年3月28日に本邦でも薬事承認された。
HER2検査のタイミングと方法
TRIUMPH試験では、 年齢が20歳以上、 PS 0~1、 フッ化ピリミジン、 イリノテカン、 オキサリプラチンおよび抗EGFR抗体薬に不応または不耐となったRAS遺伝子野生型かつHER2陽性の患者が対象となっており、 それ以外の患者に対する有効性、 安全性は確認されていない。 しかしながらペルツズマブ+トラスツズマブ療法の奏効割合が30%程度と現在の2次治療以降よりもかなり高いことから、 フッ化ピリミジン、 イリノテカン、 オキサリプラチンに不応または不耐となった患者に対する新たな有力な治療選択肢である。
MyPathway試験においては、 抗EGFR抗体薬の治療歴がなかった症例において、 治療歴があった症例よりも奏効割合が高い傾向となっていた。 抗EGFR抗体薬投与前にペルツズマブ+トラスツズマブ療法を使用することはこの結果からは選択肢となる。
HER2検査のタイミング
こうしたことからHER2検査のタイミングとしては、 1次治療終了時点では少なくとも結果が分かっている状態が望ましく、 1次治療中もしくは1次治療開始前に提出するのが良いと考える。 HER2陽性の診断には免疫組織化学検査 (Immunohistochemistry:IHC) としてベンタナ ultraView パスウェーHER2 (4B5) が、 蛍光 in situ ハイブリダイゼーション法 (fluorescence in situ hybridization:FISH法) としてパスビジョン®HER-2 DNAプローブキットがコンパニオン診断薬として承認されている。 これらはいずれも腫瘍検体を用いての検査となることを考えると、 治療開始前に行うRAS/BRAF遺伝子検査およびMSI検査とともに行うことが腫瘍検体の損失を避ける意味でも妥当である。
包括的がんゲノムプロファイリング検査
また、 包括的がんゲノムプロファイリング検査でエキスパートパネルがHER2陽性と判断し、 ペルツズマブ+トラスツズマブ療法を提案し使用することも可能である。 しかしこの場合には現状の包括的がんゲノムプロファイリング検査のタイミングが3次治療付近となることから、 HER2治療が後方治療となってしまう。
基本的にはIHCまたはFISHでの検査で早期から行っていくことが望ましい。
今後の展望
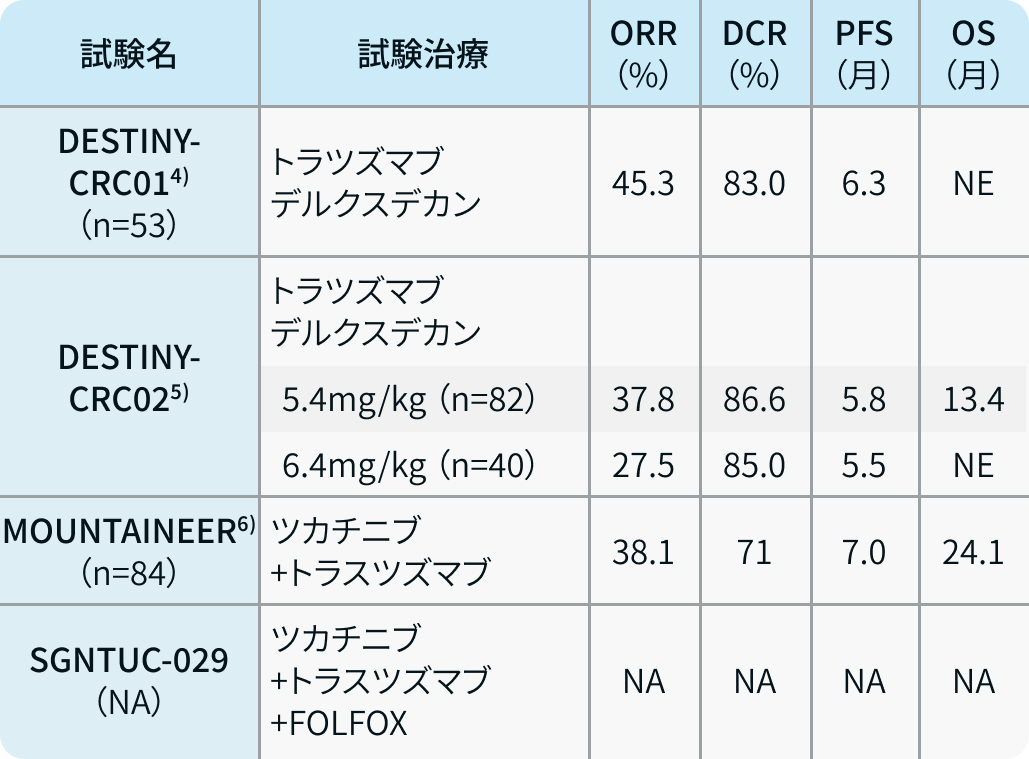
DESTINY-CRC01試験とDESTINY-CRC02試験
標準治療終了後のHER2陽性切除不能進行・再発大腸癌を対象として、 HER2に対する抗体薬物複合体であるトラスツズマブ デルクスデカン (TDXd) の有効性を検討した第II相試験であるDESTINY-CRC01試験⁴⁾が行われている。 この試験では53例が対象となっており、 奏効割合が45.3%と高かった。 この結果からNCCNガイドラインにおいてはHER2陽性大腸癌に対する治療選択肢として、 TDXdがペルツズマブ+トラスツズマブに並んで推奨されている。
また、 TDXdの用量を5.4mg/kgと6.4mg/kgに設定して比較するDESTINY-CRC02試験⁵⁾が米国臨床腫瘍学会(ASCO 2023)において報告されている。 奏効割合はそれぞれ37.8%と27.5%であり、 ともに良好であった。 特にIHCでHER2 3+において46.9%と29.4%と、 HER2 2+/ISH+に比較して良好であった。 こうした結果から、 今後本邦においてもTDXdはHER2陽性大腸癌の治療選択肢となる可能性がある (表2)。
表1
MOUNTAINEER試験とSGNTUC-029試験
さらに現在HER2の選択的なチロシンキナーゼ阻害薬であるツカチニブの開発が進んでいる。 ツカチニブ+トラスツズマブ併用療法を標準治療終了後のHER2陽性切除不能進行・再発大腸癌に検討した第II相試験であるMOUNTAINEER試験⁶⁾が行われ、 良好な結果が報告されている。 これを踏まえて、 未治療のHER2陽性切除不能進行・再発大腸癌においてツカチニブ+トラスツズマブ+FOLFOXを標準治療と比較検討する第Ⅲ相試験であるSGNTUC-029試験も現在進行中であり、 こうした結果から1次治療でHER2を標的とした治療が登場する可能性もある (表2)。
表2
HER2標的の治療は有効性が期待できる治療であり、 可能な限り早い段階での検査を行い、 治療導入のタイミングを考慮する必要がある。
参考文献
- Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol. 2016 Jun;17(6):738-746. PMID: 27108243
- Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol. 2019 Apr;20(4):518-530. PMID: 30857956
- Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer: a phase 2 trial. Nat Med. 2021 Nov;27(11):1899-1903. PMID: 34764486
- Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial. Lancet Oncol. 2021 Jun;22(6):779-789. PMID: 33961795
- Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): Primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol. 2023;41(suppl_16):3501.
- Tucatinib plus trastuzumab for chemotherapy-refractory, HER2-positive, RAS wild-type unresectable or metastatic colorectal cancer (MOUNTAINEER): a multicentre, open-label, phase 2 study. Lancet Oncol. 2023 May;24(5):496-508. PMID: 37142372
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。