HOKUTO編集部
2年前
【注目キーワード】肺癌領域初の抗体薬物複合体 「T-DXd」

本稿では肺癌領域における注目キーワードについて解説していく。 第1回となる今回は、2023年8月に、 既治療HER2遺伝子変異陽性非小細胞肺癌 (NSCLC) に適応拡大となった抗体薬物複合体 (Antibody drug conjugate ; ADC) のトラスツズマブ デルクステカン (Trastuzumab deruxtecan ; T-DXd、 商品名エンハーツ) について概説する (解説医師 :国立がん研究センター中央病院呼吸器内科医長 吉田達哉先生)。
従来の分子標的治療薬とは異なるコンセプトの薬剤が承認
T-DXdは、 肺癌領域で初めて承認されたADCであり、 HER2遺伝子変異陽性非小細胞肺癌に対して、 非常に良好な治療成績を示した¹⁾。
‐ 奏効割合 : 49.0%
‐ 無増悪生存期間 : 9.9ヵ月
これまで肺癌領域においては、 初回治療前にEGFRやALKなどの遺伝子変異を検索し、 その遺伝子変異が陽性であった場合に、 分子標的治療薬であるオシメルチ二ブやアレクチニブなどのチロシンキナーゼ阻害薬を使用することが一般的であった。
一方、 今回適応拡大となったADCであるT-DXdは、 これまでの分子標的治療薬とは、 全く異なるコンセプトの薬剤である。 本稿では、 ADCおよびT-DXdを取り上げる。
ADCの特徴
分子構造
ADCは、 ペイロード、 モノクローナル抗体、 リンカーの3つの部分で成り立っている (図1) ²⁾。
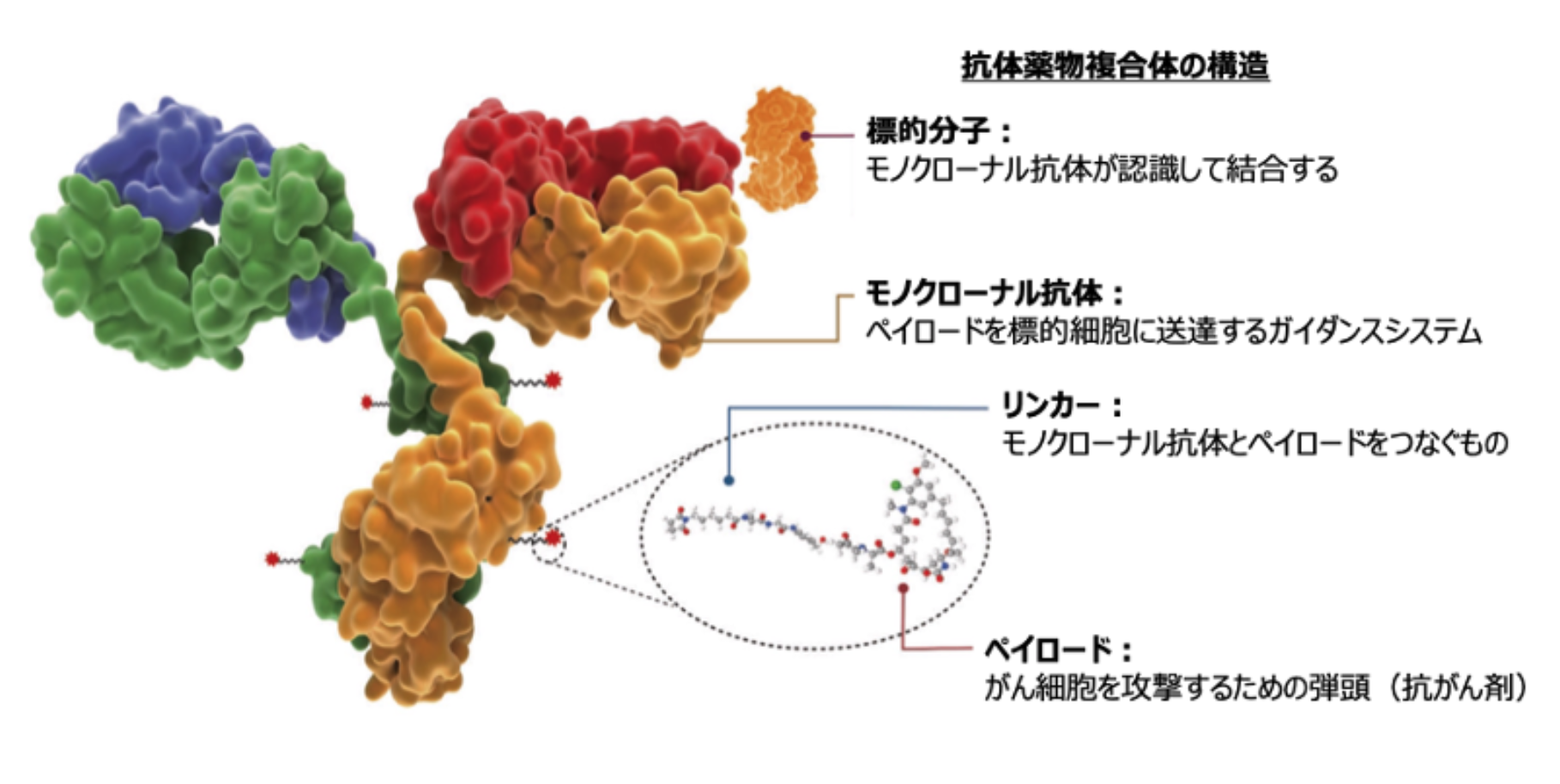
図1. 抗体薬物複合体の概略構造 (吉田達哉氏提供)
ペイロードは、 がん細胞を破壊するための弾頭であり、 抗癌剤である。 モノクローナル抗体は、 この弾頭を標的細胞に運搬するガイダンスシステム。 リンカーは、 ペイロードとモノクローナル抗体をつなぐものである。
実際、 T-DXdでは、 イリノテカンの活性本体であるSN-38と比較して約10倍という、 高いトポイソメラーゼⅠ阻害活性を有しているDXdが、 1抗体につき約8分子リンカーで結合している。
癌細胞に作用するメカニズム
まずモノクローナル抗体 (T-DXdの場合にはトラスツズマブ) 部分が、 癌細胞に発現している標的分子 (T-DXdの場合にはHER2) を認識して結合する。 そして結合したADCが細胞内に取り込まれ、 細胞内でリンカーが切断され、 ペイロード (DXd) が放出され、 標的となった癌細胞に治療効果を発揮する (図2) ³⁾。
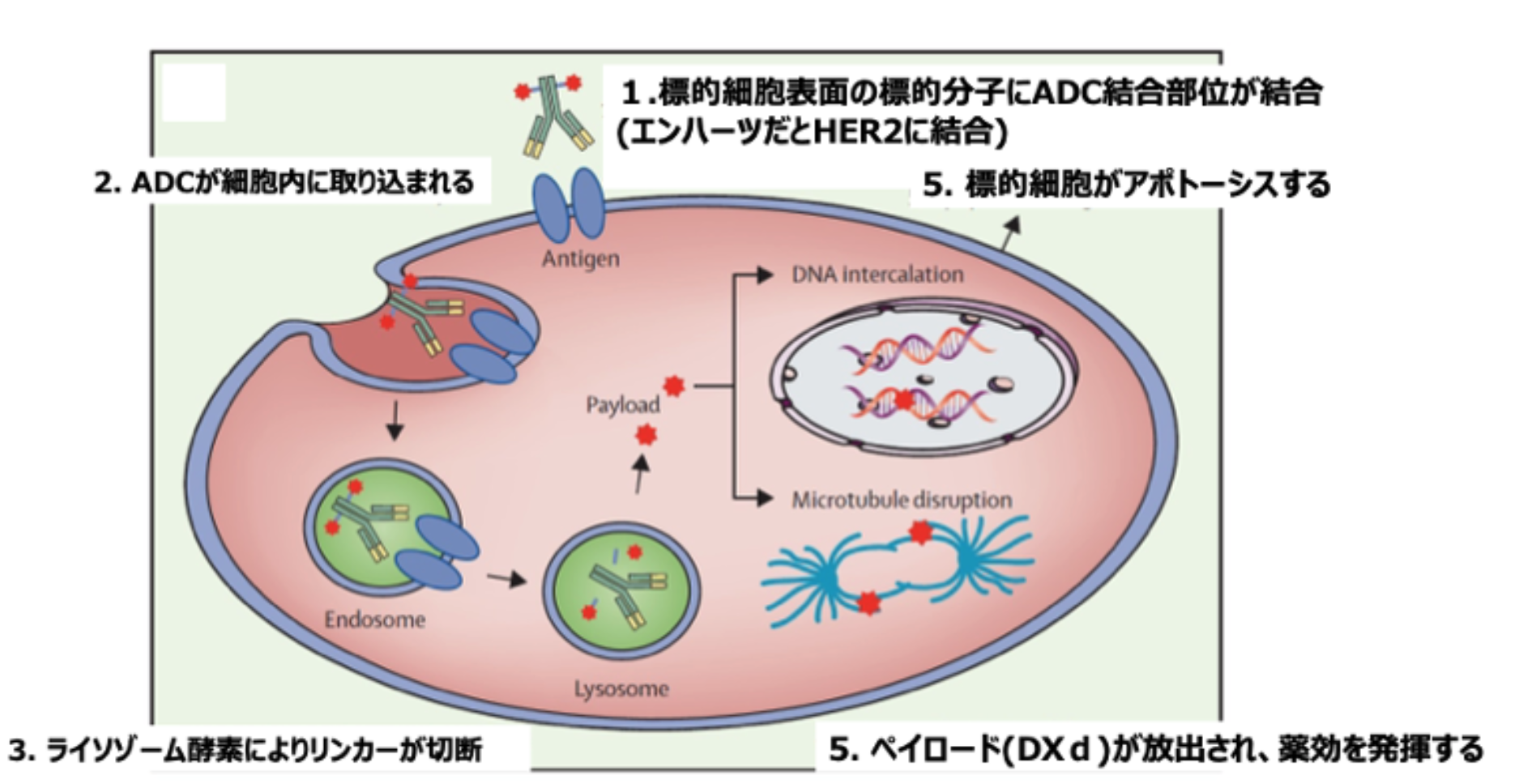
図2. 抗体薬物複合体の作用機序 (吉田達哉氏提供)
肺癌領域で新規ADCの開発進む
T-DXdなどのADCは、 上記のような作用機序によって、 これまでには全身投与できなかった抗癌剤を癌細胞に送達することで薬物の全身暴露 (毒性) を抑えつつ、 癌細胞への攻撃力を高めることができる次世代の抗癌剤治療として認識されるようになっている。 現在、 肺癌領域では、 TROP2、 MET、 EGFRなどのさまざまな分子を標的として新規ADCが複数開発中である。
一方で、 ADCは、 毒性を抑えつつといっても、 完全に毒性を抑えることはできない。 特に吐気や食欲低下などの消化器毒性や薬剤性肺障害は、 頻度は少ないといっても発症する可能があり、 これまでの抗癌剤治療と同様に有害事象対策が必要である。
参考文献
- Goto K, Goto Y, Kubo T et al. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non-Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol 2023; 41 (31): 4852-4863. PMID: 37694347
- Fu ZW, Li SJ, Han SF et al. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93. PMID: 35318309
- Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet 2019 Aug 31;394(10200):793-804. PMID: 31478503
解説医師

関連コンテンツ
💉 T-DXd
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。