HOKUTO編集部
4日前
本邦初の吸収性食道用ステントが承認、 保険適用の手続きへ

国立がん研究センターは6月3日、 同センター東病院とパイオラックスメディカルデバイスが共同研究で臨床試験を行った 「ELLA-BDステントPX」 が、 3月7日付で薬事承認を取得し、 今後は本邦初の 「吸収性食道用ステント」 として新たな特定保険医療材料区分での保険適用の手続きを行うと発表した。
開発の背景
難治性食道良性狭窄における嚥下障害とQOL低下が課題
食道癌に対する標準的治療は外科手術が推奨されているが、 早期発見された患者に対しては内視鏡を用いた切除が推奨されている。 広範な食道癌に対する内視鏡切除では、 内視鏡的粘膜下層剥離術 (ESD) *が行われることが一般的だが、 癌を切除したにも関わらず、 一定の割合で術後の食道に良性狭窄を発症する場合がある。
現在、 この食道良性狭窄に対しては、 内視鏡的バルーン拡張術 (EBD) **やブジー法***による治療が一般的に行われているが、 これらの既存治療を施しても繰り返し狭窄を発現する難治性食道良性狭窄の患者において嚥下障害やQOLの低下が課題となっている。
*早期の消化管癌や前癌病変に対して行われる内視鏡治療の一つで、 病変の周りの粘膜下層を切開し、 粘膜下層から病変を切除する。 特に、 広範囲にわたる病変や、 EMRでは切除が難しい症例に適した治療法
**食道や腸管などの消化管が狭くなった部分 (狭窄部) に対し、 内視鏡を用いてバルーン (風船状の器具) を挿入し、 内部から拡張する治療法
***消化管の狭くなった部分 (狭窄部) に対して、 細長い棒状の器具 (ブジー) を挿入して、 徐々に拡張する治療法
発表のポイント
生分解性素材使用で留置後の抜去不要に
「ELLA-BDステントPX」 は、 標準的治療で治療困難な難治性食道良性狭窄に対して使用される生分解性ステント。 「ELLA-BDステントPX」 は生分解性素材の一つで、 外科用縫合糸として広く使用されているポリジオキサノンを使用しており、 食道癌手術などの後に起こることがある食道良性狭窄の患者に留置することで、 食道の通りを良くする。
この生分解性の特性により、 体内に留置されたステントは約3ヵ月で分解・吸収されるため、 体外への抜去が不要となり、 患者の負担を軽減するとともにQOLの向上が期待される。
今後、 新たな特定保険医療材料区分での保険適用の手続きを行うという。

国立がん研究センターのプレスリリースより引用
先進医療Bでの試験と企業治験で嚥下障害が有意に改善
今回の承認は、 先進医療Bでの臨床試験および企業治験で、 嚥下障害評価が有意に改善された結果に基づく。
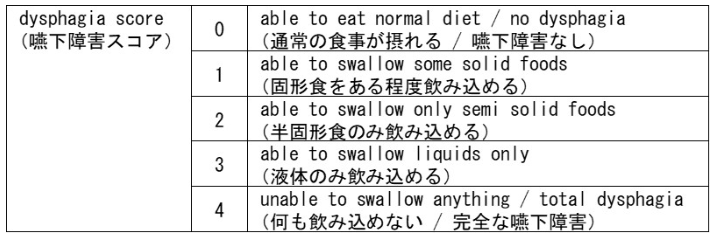
2012年5月~2015年7月に国立がん研究センター東病院を含む国内4施設において実施された先進医療Bでの臨床試験では、 食道癌治療後の難治性良性狭窄患者18例を対象に生分解性ステント留置術の有効性と安全性が評価され、 12例 (66.7%) が3ヵ月時点で食事の飲み込みづらさの症状 (嚥下障害スコア : DS) の改善を認めた¹⁾。
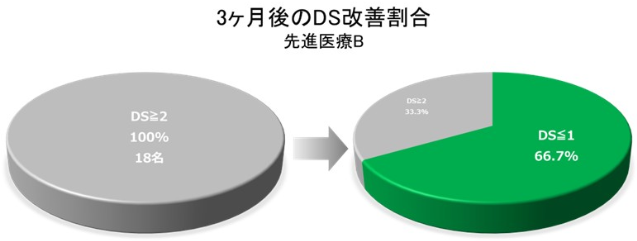
国立がん研究センターのプレスリリースより引用
また、 2017年4月~2020年3月に国立がん研究センター東病院を含む9施設で難治性良性食道狭窄患者30例を対象に生分解性ステントの有効性と安全性を評価した企業治験では、 14例 (46.7%) がDSの改善を認めた²⁾。
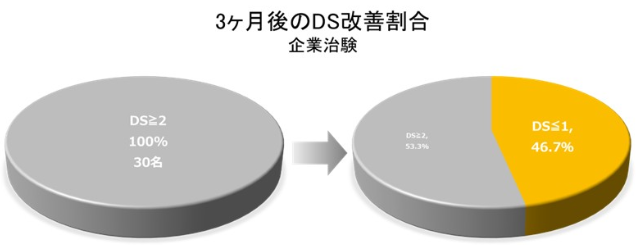
国立がん研究センターのプレスリリースより引用
出典
関連コンテンツ
食道癌 (腺癌) の臨床病期分類 (UICC-8版)
食道癌 (扁平上皮癌) の臨床病期分類 (UICC-8版)
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。