新薬承認情報
2年前
オルミエント 「若年性特発性関節炎」 への適応追加-3月の変更承認情報まとめ-
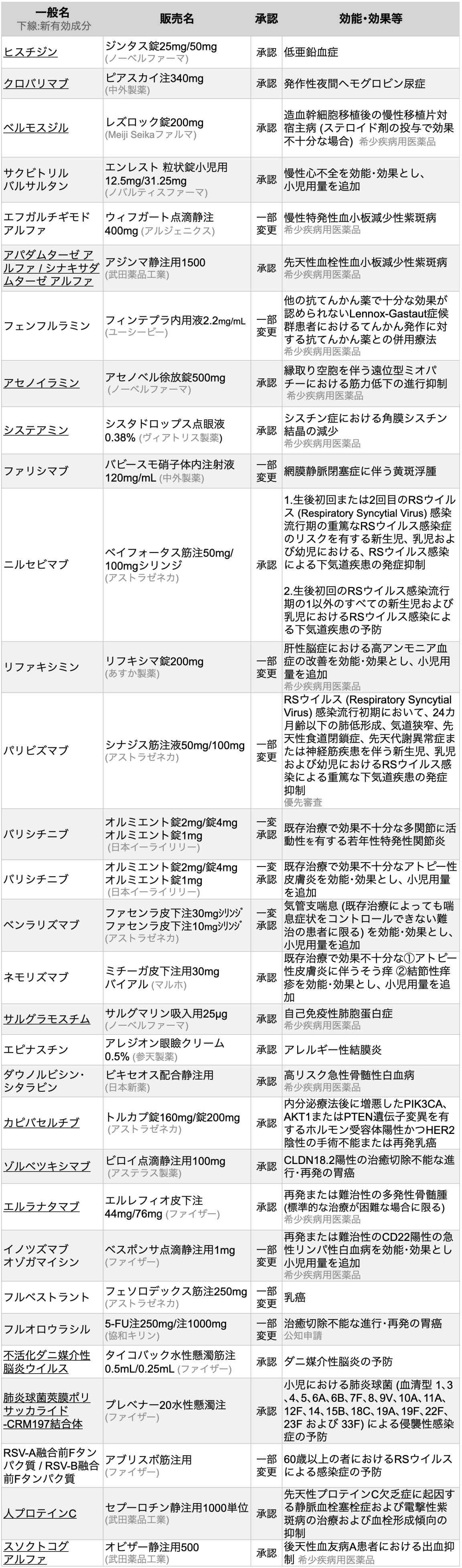
新薬含む30剤を承認
医薬品医療機器総合機構 (PMDA) は、 2024年3月に30種類の医薬品が厚生労働省から承認を受けたと発表した(うち新規有効成分14剤)。
アパダムターゼ アルファ/シナキサダムダーゼ アルファ
アパダムターゼ アルファ/シナキサダムダーゼ アルファ (商品名アジンマ) は世界初の遺伝子組換えADAMTS13製剤であり、 12歳以上の先天性血栓性血小板減少性紫斑病 (cTTP) を効能・効果として承認された。 同疾患に対する唯一の治療薬となり、 患者のアンメットメディカルニーズに応える新しい治療選択肢として期待されている。
ベルモスジル
ベルモスジル(商品名レズロック) は、 免疫細胞の分化と組織の線維化に関与するリン酸化酵素ROCK2を阻害する、 慢性移植片対宿主病 (GVHD) に対する初の選択的ROCK2阻害薬である。
造血幹細胞移植後の慢性GVHD (ステロイド剤の投与で効果不十分な場合) を効能・効果として承認され、 炎症と線維化を抑制することで効果を示すことが期待されている。
なお同薬は、 米国では2021年に、 また2023年にはカナダおよび英国でも発売されている。
イノツズマブ オゾガマイシン
抗体薬物複合体イノツズマブ オゾガマイシン (商品名ベスポンサ) は、 2018年1月に再発または難治性のCD22陽性の急性リンパ性白血病 (ALL) を効能・効果として承認され、 成人での用法・用量が既に設定されている。 今回は小児用量を小児の同疾患に対して一部変更承認された。
同薬は治療による感染症等の合併症リスクを低減し、 造血細胞移植やキメラ抗原受容体T (CAR-T) 療法への橋渡しとしての役割を担う新たな寛解導入治療薬として期待されている。
今回の承認は、 小児の再発または難治性急性リンパ性白血病患者を対象とした2件の医師主導治験、 国内第I相試験INO-Ped-ALL-1、 および国際第I/II相試験ITCC-059の結果に基づく。
エルラナタマブ
エルラナタマブ (商品名エルレフィオ) は多発性骨髄腫に対する初の抗BCMA/CD3二重特異性抗体である。 再発または難治性の多発性骨髄腫に対する治療では、 免疫調節薬、 プロテアソーム阻害薬および抗CD38抗体の3薬が用いられるものの、 これらの薬剤に抵抗性を示す患者への治療が課題となっていた。
今回の承認は、 第II相国際共同非盲検単群試験MagnetisMM-3および第I相国内試験MagnetisMM-2の結果等に基づく。
ダウノルビシン・シタラビン
ダウノルビシン・シタラビン (商品名ビキセオス) はアントラサイクリン系抗癌薬ダウノルビシンとピリミジン系代謝拮抗薬シタラビンが5 : 1のモル比で配合されたリポソーム製剤であり、 高リスク急性骨髄性白血病 (AML) を効能または効果として承認された。
同薬は骨髄で白血病細胞に取り込まれた後に成分が放出され、 抗腫瘍効果が発揮される。 AMLにおいて、 一部症例に対する治療成績は改善されているものの、 依然として十分な治療効果が得られない症例も残されており、 より有効性の高い新規治療薬が必要とされていた。
乾燥濃縮人プロテインC
乾燥濃縮人プロテインC (商品名セプーロチン) は、 先天性プロテインC欠乏症に起因する静脈血栓塞栓症および電撃性紫斑病の治療および血栓形成傾向の抑制を効能・効果として承認された。
先天性プロテインC欠乏症は、 血液凝固を抑制する働きがあるプロテインCの先天的な欠乏により血液凝固亢進状態となり、 ときに致死的な血栓症を発症する希少疾患。 重篤な後遺症を残すことが多いことで知られている。
本承認は、 主に日本人患者を対象とした第I/II相国内臨床試験および非日本人の患者を対象とした2件の第II/III相海外臨床試験に基づく。
スソクトコグ アルファ
スソクトコグ アルファ (商品名オビザー) は遺伝子組替えブタ血液凝固第VIII因子製剤であり、 後天性血友病A患者における出血抑制を効能・効果として承認された。
同疾患に対しては、 主に第VIII因子を迂回して凝固を促進するバイパス製剤や、 第VIII因子の機能を代替する抗血液凝固第IXa/X因子二重特異性抗体が使用されているが、 同薬は第VIII因子を直接的に補充する。
クロバリマブ
クロバリマブ (商品名ピアスカイ) は皮下投与型の抗補体C5リサイクリング抗体で、 発作性夜間ヘモグロビン尿症 (PNH) を効能または効果として承認された。
抗原に1回しか結合できない一般的な抗体に対し、 同薬は繰り返し抗原に結合することで、 4週1回、 かつ少量の皮下投与で持続的な補体阻害が可能となる。 また、 同薬は2月に中国で世界初の承認を取得しており、 米国や欧州でも申請中である。
今回の承認はC5阻害薬による治療歴のない発作性夜間ヘモグロビン尿症患者を対象とした第III相国際共同臨床試験非盲検無作為化比較試験COMMODORE2、 および既存のC5阻害薬からクロバリマブに切替えを行ったPNH患者を対象とした第III相非盲検無作為化比較試験COMMODORE1等の結果に基づく。
エフガルチギモド アルファ
抗FcRn抗体エフガルチギモド アルファ (商品名ウィフガート) は、 既承認の全身型重症筋無力症 (gMG) に続き、 慢性特発性血小板減少性紫斑病 (ITP) に追加承認された。 疾患を引き起こす原因であるIgG抗体の分解を妨げる役割を担うFcRnに結合し、 FcRnを遮断することで、 IgG抗体値を減少させる。
なお、 ITPに対する同薬の用法・用量は、 既承認のgMGとは異なる。
ベンラリズマブ
ベンラリズマブ (商品名ファセンラ) は抗IL-5抗体であり、 気管支喘息 (既存治療によっても喘息症状をコントロールできない難治の患者に限る) を効能・効果とし、 小児用量および剤形が追加承認された。 難治の気管支喘息小児患者に対する新たな治療選択肢として期待されている。
本邦における重症喘息に対する生物学的製剤には、 同薬のほか、 抗IgE抗体オマリズマブ (ゾレア®️) や抗IL-5抗体メポリズマブ (ヌーカラ®️)、 抗IL-4/13受容体抗体デュピルマブ (デュピクセント®️) が適応となっている。
バリシチニブ
JAK阻害薬バリシチニブ (商品名オルミエント) は既存治療で効果不十分な多関節に活動性を有する若年性特発性関節炎 (JIA) を効能または効果として承認された。
JIAは、 16歳未満で発症する6週間以上持続する原因不明の関節炎と定義される自己免疫疾患であり、 小児期リウマチ性疾患に分類される。 JAK阻害薬として、 多関節に活動性を有するJIAの適応取得は同薬が初となる。
カピバセルチブ
カピバセルチブ (商品名トルカプ) は国内初のAKT阻害薬である。 内分泌療法後に増悪したPIK3CA、 AKT1またはPTEN遺伝子変異を有するホルモン受容体 (HR) 陽性かつHER2 陰性の手術不能または再発乳癌を効能・効果として承認された。
今回の承認は、 アロマターゼ阻害薬に抵抗性を示すHR受容体陽性かつHER2陰性の手術不能・再発乳癌を対象に、 カピバセルチブ+フルベストラント群とプラセボ+フルベストラント群で比較した第Ⅲ相国際共同二重盲検無作為化比較試験CAPItello-291の結果に基づく。
フルベストラント
フルベストラント (商品名フェソロデックス) は、 上記のカピバセルチブとの併用において、 乳癌を効能・効果として一部変更承認された。
ゾルベツキシマブ
ゾルベツキシマブ (商品名ビロイ) は、 CLDN18.2陽性の治癒切除不能な進行・再発の胃癌を効能・効果として承認された。 同疾患における抗Claudin 18.2抗体の適応は世界初となる。
今回の承認は、 CLDN18.2陽性、 HER2陰性の切除不能な局所進行性または転移性の胃腺癌および食道胃接合部腺癌を対象とした第III相国際多施設共同二重盲検無作為化比較試験SPOTLIGHT、 および第III相国際多施設共同二重盲検無作為化比較試験GLOWの結果に基づく。
胃癌に対する治療は大きな進歩を遂げているものの、 その死亡率が依然として課題になっていた。 同薬の承認により、 高アンメットニーズな胃腺癌および食道胃接合部腺癌に対する新たな治療選択肢となることが期待されている。
ネモリズマブ
抗IL-31受容体A抗体ネモリズマブ (商品名ミチーガ) は、 既存治療で効果不十分なアトピー性皮膚炎に伴う掻痒 (6~13歳未満の小児)、 結節性痒疹 (成人および13歳以上の小児) を効能・効果として承認された。 同薬は2022年3月、 アトピー性皮膚炎に伴う掻痒を効能・効果として既に承認されており、 今回の承認で小児用量が追加された。
今回の承認は、 既存治療で効果不十分な中等度以上の掻痒を有する6~13歳未満の日本人アトピー性皮膚炎患者を対象とした第III相国内臨床試験、 および既存治療で効果不十分な中等度以上の掻痒を有する13歳以上の日本人結節性痒疹患者を対象とした第II/III相国内臨床試験の成績に基づく。
バリシチニブ
JAK阻害薬バリシチニブ (商品名オルミエント) は、 既存治療で効果不十分なアトピー性皮膚炎を効能・効果とし、 小児用量が追加承認された。
同薬は2020年12月、 既存治療で効果不十分なアトピー性皮膚炎を効能・効果として既に承認されており、 今回の承認で小児用量が追加された。 今回の小児適応の追加により、 2歳以上の患者にも同薬が使用できるようになる。
関連コンテンツ
免疫抑制薬 > ヤヌスキナーゼ (JAK) 阻害薬
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。