HOKUTO編集部
9ヶ月前
【24年12月承認】タルラタマブ : 再発SCLCへの新たな治療戦略

肺癌領域における注目キーワードについて解説する本シリーズ第7回は、 2024年12月に国内承認された、 再発SCLCに対する二重特異性T細胞誘導抗体タルラタマブについて概説する (解説医師 : 国立がん研究センター中央病院呼吸器内科医長 吉田達哉先生)。
SCLCの1次治療は?
抗PD-L1抗体+化学療法が標準に
非小細胞肺癌 (NSCLC) に続き、 小細胞肺癌 (SCLC) においても免疫チェックポイント阻害薬の開発が進んでいる。 未治療の進展型SCLCを対象にした第Ⅲ相試験IMpower133および第Ⅲ相試験CASPIANでは、 化学療法 (プラチナ製剤+エトポシド) と抗PD-L1抗体 (アテゾリズマブ/デュルバルマブ) の併用療法が、 化学療法単独と比較して有意に生存期間を延長したことから、 同治療レジメンは進展型SCLCにおける初回標準治療となっている¹⁾²⁾。
HOKUTO掲載の関連レジメン
CASPIAN試験 Lancet. 2019;394(10212):1929-39.
IMpower-133試験 N Engl J Med. 2018;379(23):2220-9.
SCLCの新規治療の鍵は?
免疫反応性の腫瘍微小環境への転換
一方で、 SCLCはNSCLCと比較してHLAクラスI分子の発現低下などにより、 免疫抑制的な腫瘍微小環境 (Coldな腫瘍微小環境 [Tumor microenvironment, TME]) が形成されやすいことが知られている。 また現状では、 SCLCの多くがPD-L1をほとんど発現しておらず、 Coldな腫瘍微小環境に免疫細胞を誘導して、 免疫反応性の腫瘍微小環境 (Hotな腫瘍微小環境) へ転換することが新規治療の鍵となっている。
免疫抑制機構の克服を目指した二重特異性T細胞誘導抗体タルラタマブ
近年、 この免疫抑制機構を克服するために開発されたのが、 既に造血器腫瘍に対して使用されている二重特異性T細胞誘導抗体である。 同抗体は癌細胞とT細胞を架橋、 すなわち 「T細胞を癌細胞の近くに誘導」し、 T細胞を活性化することで、 癌細胞を攻撃する薬剤である (図1) ³⁾。
▼図1. 二重特異性T細胞誘導抗体の特徴と作用機序
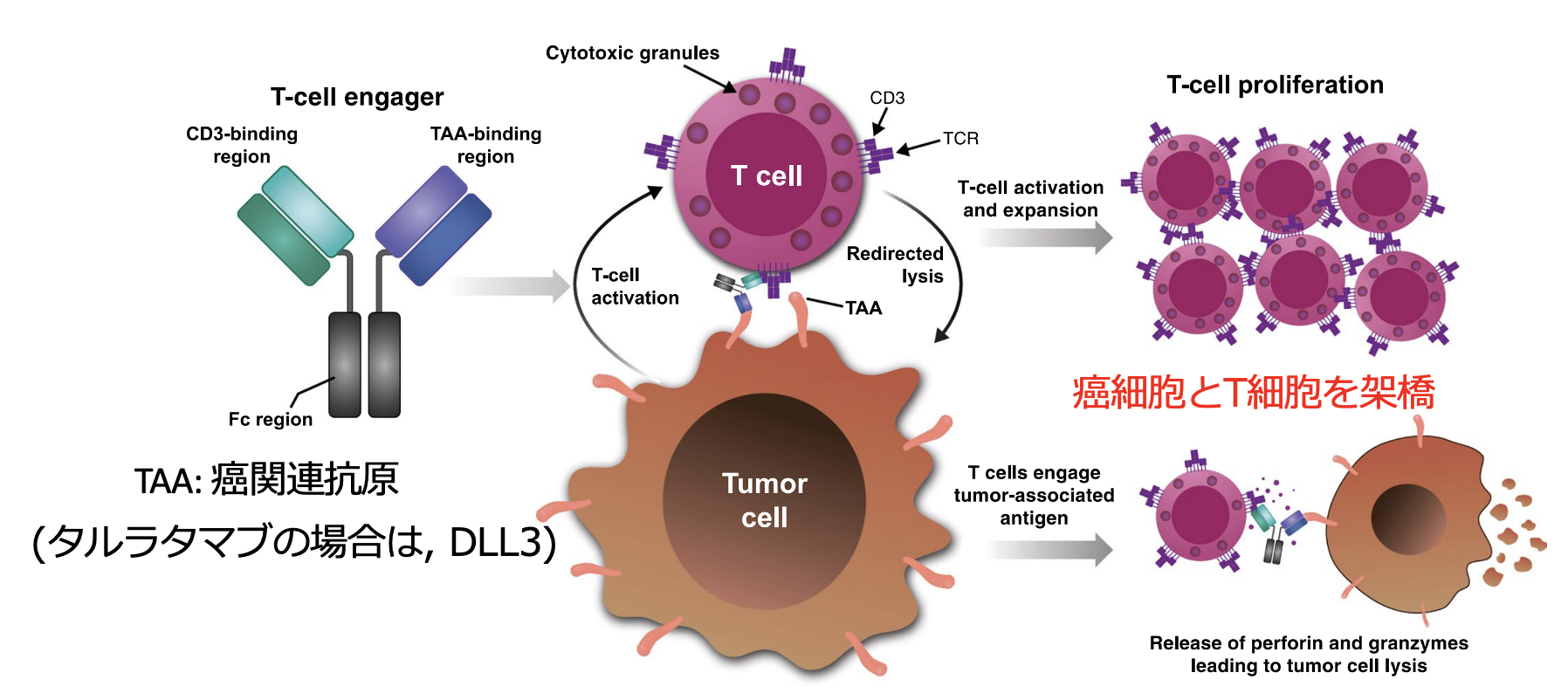
吉田達哉氏提供 (出典 : J Hematol Oncol. 2023 Jun 24;16(1):66)
▼二重特異性T細胞誘導抗体の特徴
MHC Class Iに依存せずT細胞の活性化を引き起こす ⇒MHC Class Iの発現欠失が多いSCLCにおいて最適な免疫治療の可能性 ⇒自己のT細胞を活性化して腫瘍細胞を攻撃する新規の免疫療法 (造血器腫瘍領域では有効性が証明されている : B細胞ALL に対するCD3/CD19二重特異性抗体ブリナツモマブ)
特に、 SCLCの細胞表面に発現するデルタ様リガンド3 (DLL3: Delta-like protein) ³⁾およびCD3を標的とするタルラタマブは、 早期臨床試験において有望な抗腫瘍効果を示し、 長期間の奏効が報告されている⁴⁾。
タルラタマブ、臨床試験の結果は?
Dellphi-301試験でのmOSは14.3ヵ月
第Ⅱ相国際共同非盲検無作為化比較試験Dellphi-301では、 プラチナ製剤併用療法を含む2レジメン以上の治療歴があるSCLCを対象に、 タルラタマブ10mgまたは100mgを2週間隔で投与した場合の有効性と安全性が評価された。 その結果、 有効性と安全性のバランスからタルラタマブ10mgが標準用量として選択された⁵⁾。
10m群の有効性は、 奏効率 (ORR) 40% (95%CI 29–52%)、 無増悪生存期間 (PFS) 中央値4.9ヵ月 (95%CI 2.9–6.7ヵ月)、 全生存期間 (OS) 中央値14.3ヵ月 (95%CI 10.8ヵ月–未到達) であり (図2)、 初回治療例を対象としたIMpower133試験およびCASPIAN試験の結果を上回るものであった。
▼図2. Dellphi-301試験のPFSとOS
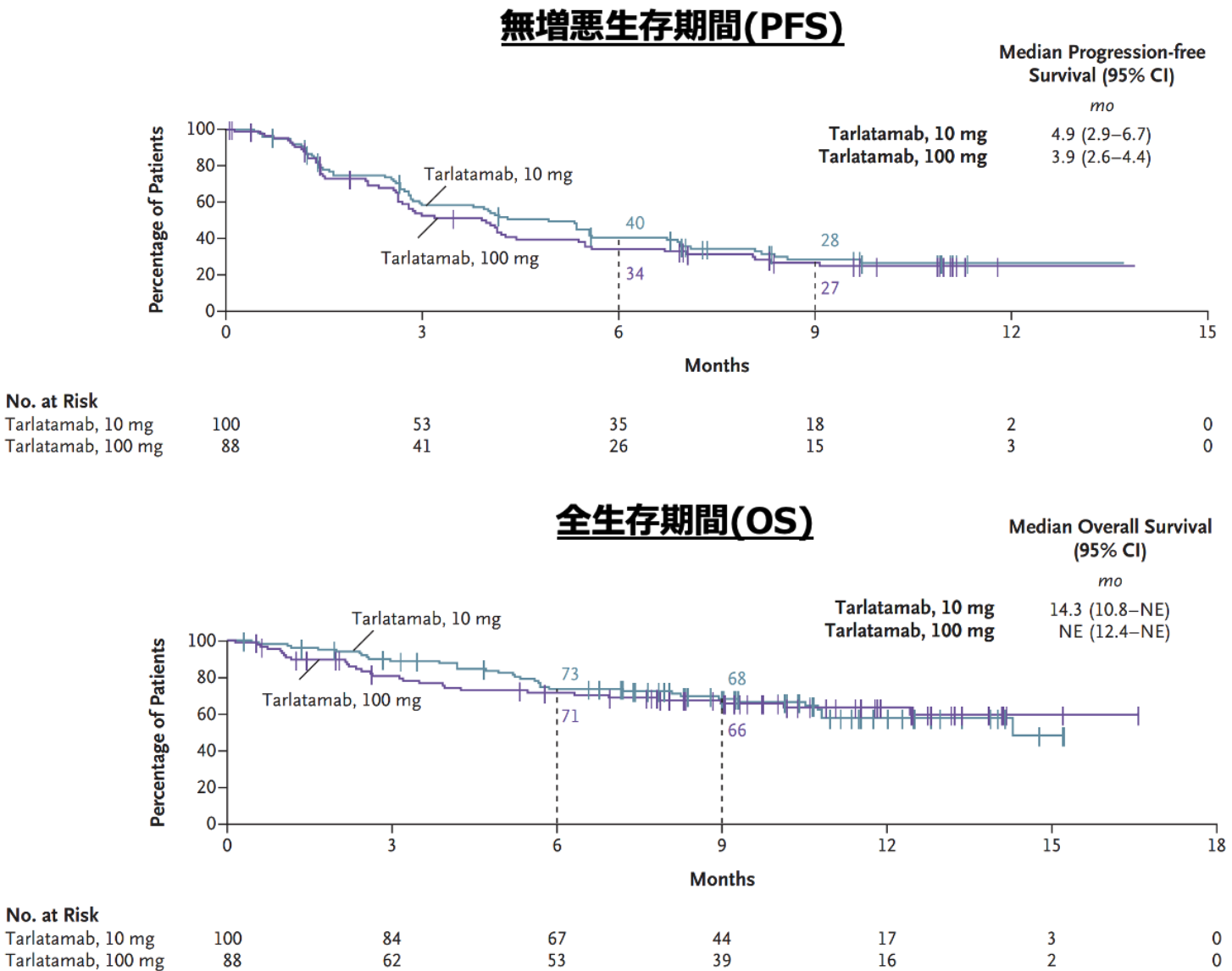
吉田達哉氏提供 (出典 : N Engl J Med. 2023 ;389(22):2063-2075)
CRSやICANS等のAE管理が重要に
有害事象 (AE) として、 サイトカイン放出症候群 (CRS) が51%という高頻度で認められ、 免疫エフェクター細胞関連神経毒性症候群 (ICANS) などの神経障害も8%報告された。 これらは従来の免疫チェックポイント阻害薬では経験しない新規AEであり、 管理が課題となっている⁴⁾⁵⁾⁶⁾。
一方で、 CRSやICANSはほとんどが1~2サイクル目に発現することが判明しており、 適切な対処方法を熟知すれば管理可能と考えられる (図3)。
▼タルラタマブによるCRS/ICANSの頻度と発現タイミング
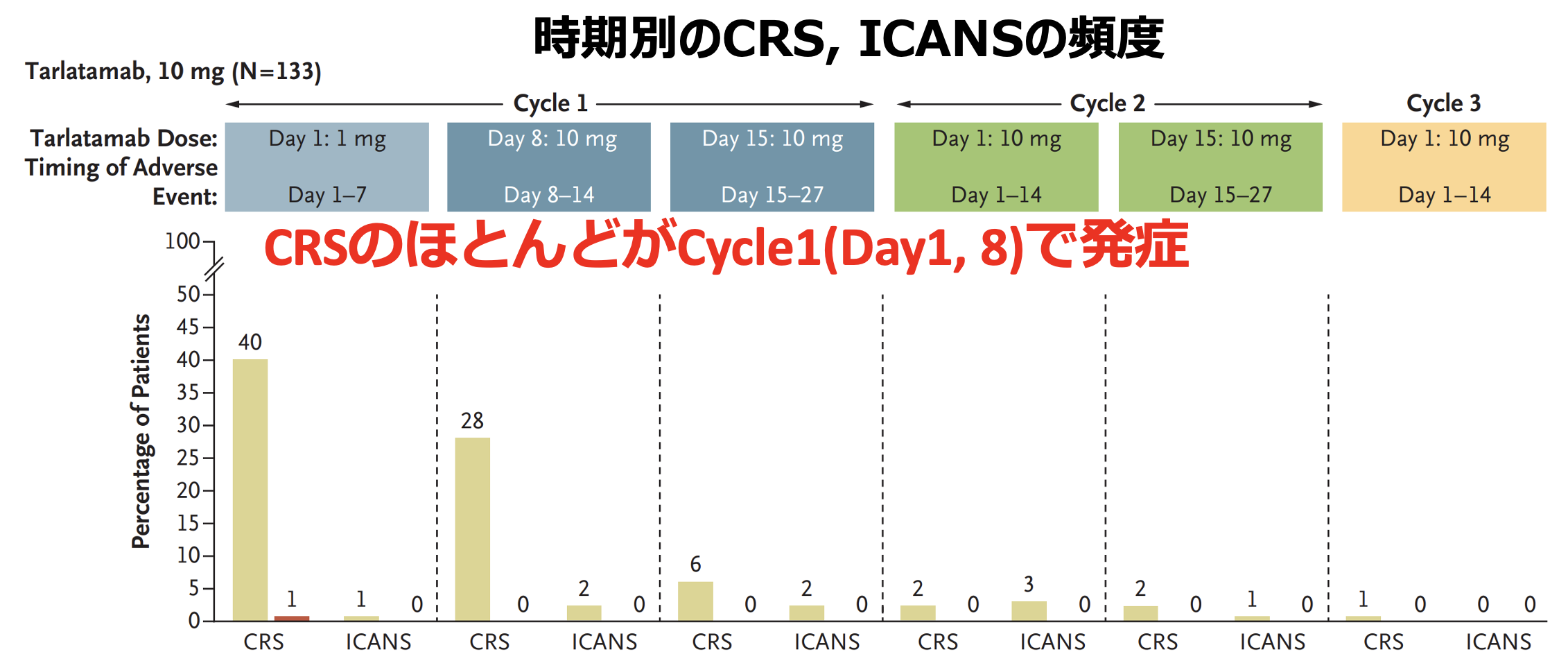
吉田達哉氏提供 (出典 : N Engl J Med. 2023 ;389(22):2063-2075)
・最終投与からの有害事象発現中央値 : 13時間 (IQR 8–27時間)
・持続期間中央値: 4日(IQR 2–6日) ただし98%が消失
・CRSの主な症状: 発熱、 低血圧、 低酸素血症
・ICANS初期症状の例 : 振戦、 書字障害、 表出性言語障害など。 中等症以上では、 傾眠、 認知機能低下、 痙攣、 せん妄など
・治療 : 副腎皮質ステロイドの投与と抗痙攣薬の予防投与
現状と今後の展望は?
日本でも承認、 第Ⅲ相試験の結果に期待
以上のDellphi-301試験の結果を受け、 本邦では2024年12月27日、 癌化学療法後に増悪したSCLCに対してタルラタマブが承認された。 現在、 プラチナ製剤併用療法後に進行したSCLCを対象とした第Ⅲ相試験Dellphi-304など、 複数の第Ⅲ相試験が進行中であり、 その結果が期待される。
(HOKUTO編集部の関連コンテンツに遷移します)

出典
¹⁾ Lancet. 2019;394(10212):1929-39.
²⁾ N Engl J Med. 2018;379(23):2220-9.
³⁾ J Hematol Oncol. 2023;16(1):66.
⁴⁾ J Clin Oncol. 2023;41(16):2893-903.
⁵⁾ N Engl J Med. 2023;389(22):2063-75.
⁶⁾ J Clin Oncol. 2023;41(16):2877-80.
関連コンテンツ
イムデトラ 「SCLC」 等への適応追加
3次治療以降にタルラタマブ療法を行うことが「弱く推奨」された
世界肺癌学会 (IASLC 2023) レポート
N Engl J Med. 2023 Nov 30;389(22):2063-2075.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。