新薬承認情報
1年前
レボレード 「再生不良性貧血」 への小児適応追加-12月の変更承認情報まとめ-
7種類を一部変更承認
医薬品医療機器総合機構 (PMDA) は、 2023年12月に7種類の医薬品が厚生労働省から承認を受けたと発表した。 いずれの薬剤も一部変更承認である。
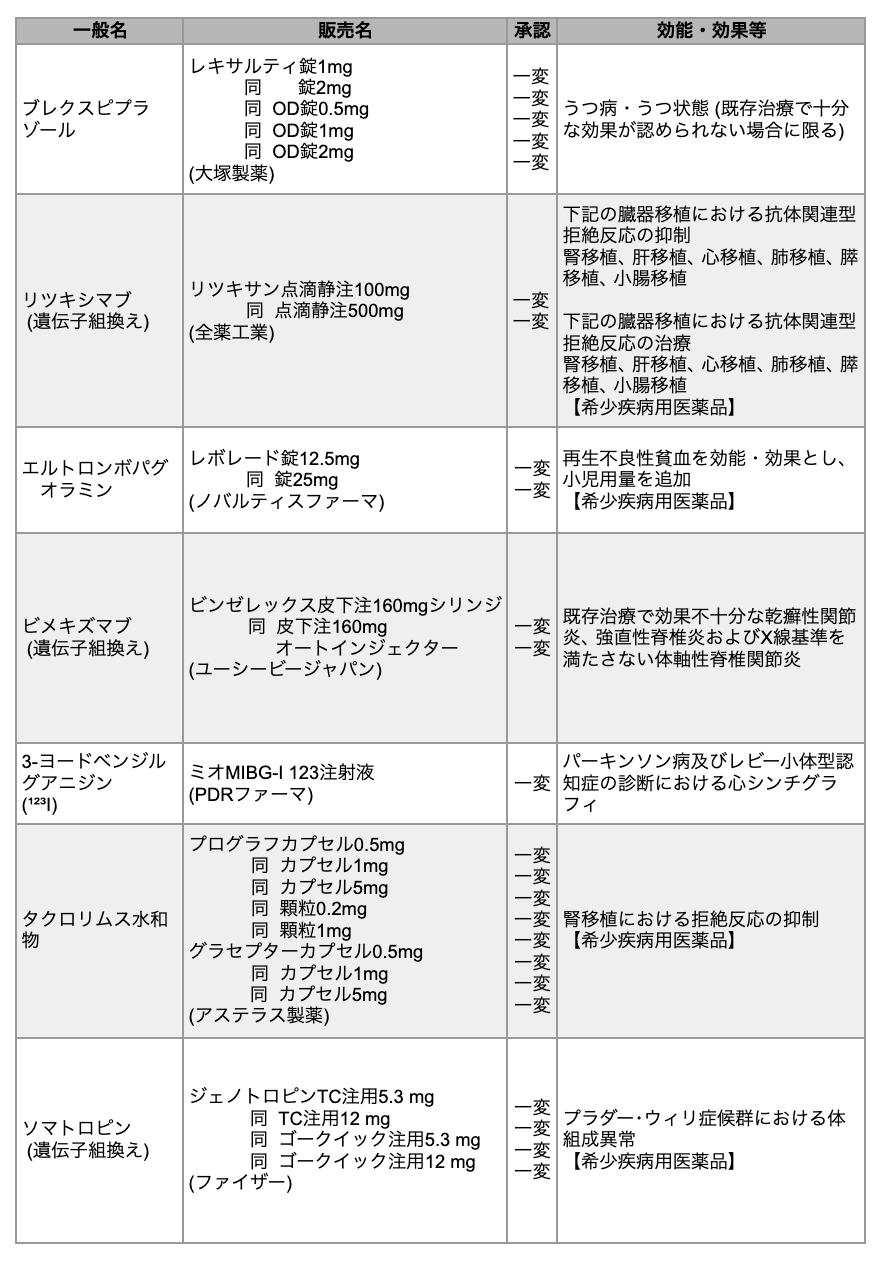
リツキシマブ
抗CD20モノクローナル抗体リツキシマブ (商品名リツキサン) は、 臓器移植*における抗体関連型拒絶反応の抑制および治療を効能・効果として追加承認された。
同薬の本適応に対する開発は、 2013年8月に日本移植学会より提出された開発要望を受け、 2018年3月に開催した 「第34回医療上の必要性の高い未承認薬・適応外薬検討会議」 での検討結果に基づき開始した。 同学会および日本医療研究開発機構移植医療技術開発研究事業により実施された治験ならびに臨床研究において得られたデータ等を根拠として、 今回の承認取得に至った。
*腎移植、 肝移植、 心移植、 肺移植、 膵移植、 小腸移植
エルトロンボパグ オラミン
トロンボポエチン受容体作動薬エルトロンボパグ オラミン (商品名レボレード) は、 再生不良性貧血を効能・効果とし、 小児用量が追加承認された。
再生不良性貧血は、 本邦では指定難病に指定され、 小児再生不良性貧血は極めて稀である。 移植適応の場合には骨髄移植が治療の第一選択となり、 非適応の場合には免疫抑制療法が選択される。 抗胸腺細胞免疫グロブリン (ATG) で未治療の場合、 成人に対しては同薬+免疫抑制療法の併用が選択肢の1つとなっているが、 小児に対してはこれまで承認されていなかった。
ビメキズマブ
抗IL-17抗体ビメキズマブ (商品名ビンゼレックス) は、 既存治療で効果不十分な乾癬性関節炎 (PsA)、 強直性脊椎炎 (AS)、 およびX線基準を満たさない体軸性脊椎関節炎 (nr-axSpA) を効能・効果として追加承認された。
今回のPsAに対する承認は第Ⅲ相BE OPTIMAL試験およびBE COMPLETE試験の、 ASとnr-axSpAに対する承認はBE MOBILE1/2試験のデータに基づく。 4件の全ての試験において、 同薬は主要評価項目ならびに主要副次評価項目を達成した。
3-ヨードベンジルグアニジン(¹²³I)
放射性医薬品3-ヨードベンジルグアニジン (¹²³I) (商品名ミオMIBG-I123) は、 パーキンソン病およびレビー小体型認知症の診断における心シンチグラフィを効能・効果として追加承認された。
両疾患を対象とした同薬の心シンチグラフィは、 適応外使用であっても保険給付の対象とすることが認められており、 臨床現場で活用されてきた。 また、 両疾患における診断基準の1つとして同薬は国内外の診療ガイドラインに採用されており、 そうした現状を踏まえ、 今回の追加承認に至った。
なお、 同薬は1992年に心シンチグラフィによる心臓疾患の診断、 2009年に腫瘍シンチグラフィによる神経芽腫の診断、 2011年に腫瘍シンチグラフィによる褐色細胞腫の診断を効能・効果としてそれぞれ承認されている。
タクロリムス
免疫抑制薬タクロリムス (商品名プログラフ/グラセプター) は、 腎移植における拒絶反応の抑制を効能・効果として、 新たな用法および用量としてそれぞれ追加承認された。
従来、 腎移植患者に対する両薬の投与方法は、 いずれも移植2日前と定められていた。 生体腎移植患者を対象とした臨床試験において、 両薬を腎移植の3日以上前より投与した際の有効性 (腎移植実施率) および安全性が確認されたことから、 今回の承認に至った。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。