HOKUTO編集部
1年前
開発が進むADC、 新ステージに進む肺癌治療を展望
本コンテンツには一部承認外情報が含まれます。

抗体薬物複合体 (ADC) の開発は近年目覚ましく、 肺癌治療において新たな治療オプションとして注目されている。 第65回日本肺癌学会では、 京都府立医科大学大学院呼吸器内科学准教授の山田忠明氏が、 肺癌治療におけるADCの開発状況を概説し、 新たなステージに進もうとしている肺癌治療について展望した。
抗体薬物複合体 (ADC) とは?
強力な細胞毒性×癌細胞への選択的な薬物送達で治療効果増強を期待
ADCは、 癌細胞への選択的な薬物送達を目的として、 特定の癌細胞上の抗原に対して高い親和性を持つモノクローナル抗体に、 ペイロードと呼ばれる化学療法薬をリンカーを介して結合させたものである¹⁾。 強力な細胞毒性と癌細胞への選択的な薬物送達により、 従来の化学療法と比べて副作用の軽減と治療効果の増強が期待されている。
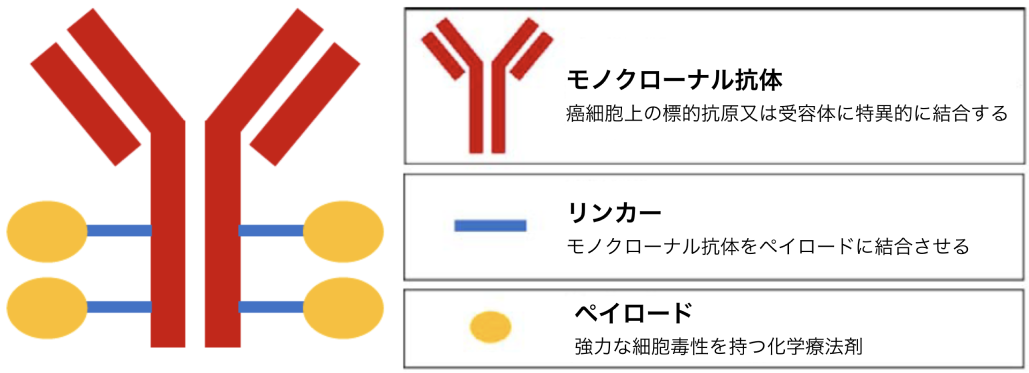
Toshiaki Takakura et al. Jpn J Clin Oncol. 2024 Aug 14;54(8):837-846. を基に編集部改変
上記3つのコンポーネントから構成されたADCは、 ①癌表面にある標的抗原 (分子) に結合、 ②エンドサイトーシスによって細胞内に取り込まれる(内在化)、 ③リソソームでの分解、 ④ペイロードの細胞内への遊離・活性化を経て、 ⑤細胞死を誘導する。 また、 ⑥細胞内へ遊離したのち、 ペイロードは細胞膜を通過して周囲の癌細胞に対して抗腫瘍効果を示す、 いわゆるバイスタンダード効果が得られる可能性がある²⁾。
NSCLCにおけるADC開発
HER2、 HER3、 TROP2、 c-METを標的分子として主要なADCを開発中
非小細胞肺癌(NSCLC)における主要なADCは以下のとおりである³⁾。
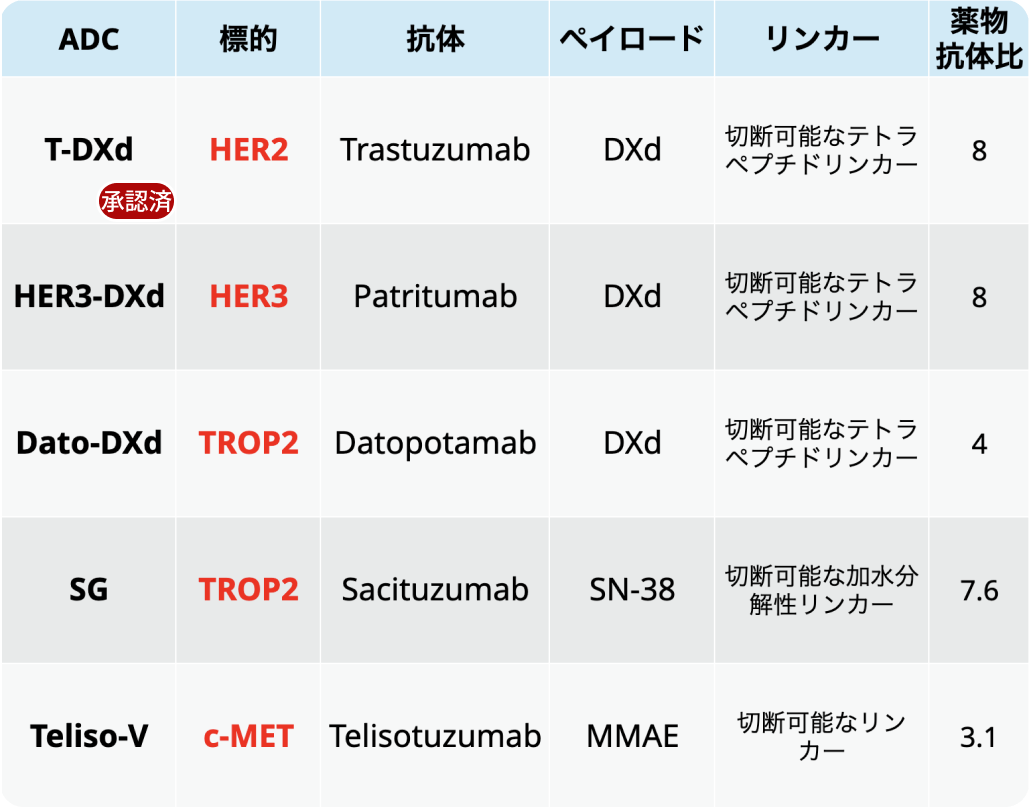
(山田忠明氏提供資料を基に編集部作成)
トラスツズマブ デルクステカン (T-DXd、 製品名 : エンハーツ®点滴静注用100mg)は、 本邦において2023年に適応追加で承認されており、 それ以外の薬剤は現在、 開発中である。 主な標的分子として、 HER2、 HER3、 TROP2、 c-METが挙げられる。
各ADCの開発状況
抗HER2 ADC (T-DXd)
T-DXdにおいて、 適応追加の根拠となった試験の一つであるDESTINY-LUNG02(NCT04644237)は、 既治療のHER2変異陽性進行NSCLC患者を対象として、 T-DXd単剤療法5.4mg/kgと6.4 mg/kgの有効性および安全性を比較評価した国際第Ⅱ相試験である。
最終解析 (データカットオフ : 2023年8月25日) において、 PFS中央値は、 5.4 mg/kg群、 6.4 mg/kg群でそれぞれ10.0ヵ月 (95%CI 7.7-15.2ヵ月)、 12.9ヵ月 (95%CI 7.2-16.7ヵ月) 、 OS中央値は19.0ヵ月(95%CI 14.7ヵ月-NE)、 17.3ヵ月 (95%CI 13.8ヵ月-NE) と5.4 mg/kg群で良好であった。 また、 Grade3以上の治療中に発現した有害事象 (TEAE) は5.4mg/kg群で少ない結果となり(39.6% vs 60.0%) 、 用量5.4mg/kgの根拠となった以前の解析と概ね一致した結果となった⁴⁾。
懸念として治療関連の間質性肺疾患 (ILD) があり、 5.4mg/kg群74例のうち11例 (14.9%) に発現した (データカットオフ : 2022年12月23日)⁵⁾。
本邦の市販後全例調査にて2020年5月25日から2022年2月24日までの間に、 独立判定委員会が治療関連のILD/肺炎と評価した130例において、 大半 (100例、 76.9%) はGrade2以下であったが、 死亡例11例のうち8例がびまん性肺胞傷害 (DAD) パターンであり⁶⁾、 注意が必要である。
>> 関連レジメン

抗TROP2 ADC (DATO-Dxd、 SG)
新たな標的分子であるTROP2は、 結合した抗体と効率的に内在化するため、 ADCにとって重要なターゲットと考えられている。 肺癌をはじめ多くの癌で発現し、 扁平上皮癌の75%、 腺癌の64%で高度発現がみられた⁷⁾。
Datopotamab deruxtecan
既治療の進行NSCLC患者を対象として、 ドセタキセル (DTX) を対照にDatopotamab deruxtecan (Dato-Dxd) の有効性および安全性を評価した国際第Ⅲ相試験TROPION-Lung01 (NCT04656652)において、 主要評価項目である盲検下独立中央判定 (BIRC) による無増悪生存期間(PFS)中央値は、 Dato-Dxd群で有意に延長した [4.4ヵ月(95%CI 4.2-5.6ヵ月) vs 3.7ヵ月 (95%CI 2.9-4.2ヵ月) 、 HR 0.75 (95%CI 0.62-0.91) 、 p=0.004]。 特に、 非扁平上皮NSCLC患者では大きな改善が認められた [5.5ヵ月 (95%CI 4.3-6.9ヵ月) vs 3.6ヵ月 (95%CI 2.9-4.2ヵ月) 、 HR 0.63 (95%CI 0.51-0.79) ] (データカットオフ : 2023年3月29日) 。
もう一つの主要評価項目である全生存期間 (OS) 中央値は、 最終解析においてDato-Dxd群で有意差が示されなかった [12.9ヵ月(95%CI 11.0-13.9ヵ月) vs 11.8ヵ月 (95%CI 10.0-12.8ヵ月) 、 HR 0.94 (95%CI 0.78-1.14) 、 p=0.530]。 一方で、 サブグループ解析では、 非扁平上皮NSCLC患者において、 Dato-Dxd群で改善傾向が示され [14.6ヵ月 (95%CI 12.4-16.0ヵ月) vs 12.3ヵ月 (95%CI 10.7-14.0ヵ月) 、 HR 0.84 (95%CI 0.68-1.05) ]、 PFS同様に組織型による差が認められた (データカットオフ : 2024年3月1日) 。
ADCは副作用の軽減も期待されるところで、 実際に、 Grade3以上の治療関連有害事象 (TRAE) は、 DTX群42.1%に比べてDato-Dxd群25.6%と少ないが、 一方で、 Grade3以上のILDまたは肺臓炎は、 DTX群1.4%に比べてDato-Dxd群3.7%と多く⁸⁾、 この既知のAEについては対応が必要である。
Dato-Dxdは、 米国において2024年2月に、 局所進行または転移性の非扁上皮NSCLCに係る2次/3次治療を対象とした生物学的製剤承認申請が受理されたが、 その後、 2024年11月に申請の取り下げが行われている。
📘TROPION-Lung01試験の詳細はこちら
>> PFSの結果報告
>> OS最終解析の結果報告
📘TROPION-Lung02試験の詳細はこちら
サシツズマブ ゴビテカン
プラチナベースの化学療法または免疫チェックポイント阻害薬の治療により病勢進行 (PD) となった進行NSCLCを対象として、 サシツズマブ ゴビテカン (SG) とドセタキセル (DTX) の有効性および安全性を比較評価した国際第Ⅲ相試験EVOKE-01(NCT05089734)において、 主要評価項目であるOS中央値は有意差が示されなかった [SG群 : 11.0ヵ月 (95%CI 9.4-12.3ヵ月) 、 DTX群 : 9.8ヵ月 (95%CI 8.1-10.6ヵ月) 、 HR 0.84 (95%CI 0.68-1.04) 、 p=0.0534] ⁹⁾。
現在、 ペムブロリズマブとの併用による第Ⅱ相試験EVOKE-02 (NCT05186974) 、 PD-L1高度発現例の1次治療に関する第III相試験EVOKE-03 (NCT05609968) が進行中である。 現時点においてFDAへの承認申請は行われていない。
抗c-MET ADC(Teliso-V)
c-METは、 非扁平上皮EGFR野生型NSCLC患者の25%で癌細胞膜表面に過剰発現している標的分子である。
既治療のc-MET過剰発現・進行NSCLCを対象として、 3次治療以降におけるTelisotuzumab vedotin(Teliso-V)の有効性および安全性を評価した単群第Ⅱ相試験LUMINOSITY (NCT03539536) において、 主要評価項目である全奏効率 (ORR) は、 全集団において28.6% (95%CI 21.7-36.2%) と一定の抗腫瘍効果を示し、 また、 高度発現患者において中等度発現患者より良好な結果が示された [34.6% (95%CI 24.2-46.2%) vs 22.9% (95%CI 14.1-33.4%) ]。
PFSおよびOSの中央値も、 全集団においてそれぞれ5.7ヵ月 (95%CI 4.6-6.9ヵ月) 、 14.5ヵ月 (95%CI 9.9-16.6ヵ月) と一定の抗腫瘍効果を示したが、 一方で、 高度発現患者と中等度発現患者で大きな差は認められなかった [PFS : 5.5ヵ月 (95%CI 4.1-8.3ヵ月) vs 6.0ヵ月(95%CI 4.5-8.1ヵ月)、 OS : 14.6ヵ月 (95%CI 9.2-25.6ヵ月) vs 14.2ヵ月 (95%CI 9.6-16.6ヵ月) ] ¹⁰⁾。 c-MET発現量は効果と相関が認められず、 バイオマーカーという観点からは心許ない結果となった。
Teliso-Vは、 本邦において2023年3月7日に 「先駆的医薬品指定制度」 の対象品目に指定され、 米国において2024年9月27日にFDAへ承認申請している。
HER3 ADC(HER3-Dxd)
EGFR-TKI耐性後のEGFR変異陽性NSCLCの次治療において、 第Ⅰ相試験の結果からHER3が標的分子として注目されている。
EGFR-TKIおよびプラチナベースの化学療法によりPDとなった進行EGFR変異陽性NSCLC患者を対象として、 Patritumab deruxtecan (HER3-Dxd) の有効性および安全性を評価した国際第Ⅱ相試験HERTHENA-Lung01 (NCT04619004) において、 主要評価項目であるBIRCによるORRは29.8% (95%CI 23.9-36.2%) であった。 第3世代EGFR-TKI耐性例で29.2%、 EGFR-TKI依存性のon target耐性例で32.4%、 EGFR-TKI非依存性のoff target耐性例で27.2%と、 耐性あるいは耐性の原因に関わらず一定の抗腫瘍効果を示した。
また、 PFS中央値は5.5ヵ月 (95%CI 5.1-5.9ヵ月) 、 OS中央値は11.9ヵ月 (95%CI 11.2-13.1ヵ月) 、 奏効期間 (DOR) 中央値は6.4ヵ月(95%CI 4.9-7.8ヵ月)であった¹¹⁾。 本試験において、 HER3発現量と効果に相関が認められず、 適切なバイオマーカーが必要である。
HER3-Dxdは、 前述のHERTHENA-Lung01試験の結果に基づき、 EGFR変異を有する局所進行または転移性NSCLC患者に係る3次治療を対象として、 米国において2023年12月にFDAで承認申請されたが、 その後、 FDAより審査完了報告通知 (Complete Response Letter) が出され、 審査終了目標日の2024年6月26日までに本剤を承認できない旨が通知された。
現在は、 第3世代EGFR-TKI治療後にPDとなった進行EGFR変異陽性NSCLC患者を対象として、 Patritumab deruxtecan (HER3-Dxd) とプラチナベースの化学療法の有効性および安全性を比較評価した国際第Ⅲ相試験HERTHENA-Lung02(NCT05338970)が進行中である。 現時点において、 主要評価項目であるPFSは、 プラチナベースの化学療法に対して統計的に有意な改善を示したことが開発元の第一三共社からリリースされている。
また、 EGFR阻害 (オシメルチニブ投与) により細胞膜表面のHER3発現が増加し、 HER3-DXdの内在化および抗腫瘍効果を高めることが報告されており¹²⁾、 こうした基礎的な背景を受け、 未治療の進行EGFR変異陽性NSCLC患者を対象として、 HER3-DXdとオシメルチニブの併用療法の有効性および安全性を評価した第Ⅰ相試験(NCT04676477)が進行中である。
ADCに対する主な獲得耐性機構
MOAの各段階で起こる耐性メカニズム
ADCではさまざまな獲得耐性が起こりうる。 ADCの作用機序 (MOA) の各段階において、 それぞれ①抗体結合能の低下 (抗原発現レベルの変化や変異) 、 ②内在化の障害、 ③リソソーム分解、 ④ペイロードの汲み出し――といった耐性のメカニズムがみられ、 その他として⑤bypassシグナル活性化も報告されている¹³⁾。
ADCによる治療域拡大の可能性と現状
仮説と一致せぬ現状の臨床データ
ADCは、 モノクローナル抗体の選択性とペイロードの強力な細胞毒性を掛け合わせることで、 癌細胞に特異的にペイロードを送達できるため、 正常組織への毒性を低下し、 free drugと比べて治療域は広いと考えられている。
前臨床データでは、 通常の薬剤と比べてペイロードの最小有効用量 (MED) が減少し、 最大耐用量 (MTD) が増加して治療域が拡大する上記仮説が実証されたが、 現状の臨床データはこれと一致せず、 MTDがfree drugと大きく変わらないことが示された。 一方で、 ADCは、 MTDあるいはその近くまで投与した場合、 free drugより治療反応性が良好であったという¹⁴⁾。
高品質なADCの創薬と臨床への寄与を期待
山田氏は 「肺癌治療は、 ADCの開発・発展により新たなステージに進もうとしている。 今後は、 高品質なADCの創薬が大きな課題であり、 適切なバイオマーカーの確立や、 耐性機構の解明・克服も重要となる。 また、 ADCと他剤のシナジー効果に期待した併用治療の開発状況も注視していく必要がある。 技術革新を経て誕生したADCのさらなる発展と臨床への寄与に期待したい」 と展望した。
出典
¹⁾ Jpn J Clin Oncol. 2024; 54: 837-846.
²⁾ Pharmacol Ther. 2018: 181: 126-142.
³⁾ Ann Oncol. 2024; 35: 607-629.
⁴⁾ J Clin Oncol 2024; 42 (16_suppl): 8543-8543.
⁵⁾ J Clin Oncol. 2023; 41: 4852-4863.
⁶⁾ Int J Clin Oncol. 2023; 28: 1585-1596.
⁷⁾ Oncotarget. 2017; 8: 28725-28735.
⁸⁾ J Clin Oncol. 2024 Sep 9:JCO2401544.
⁹⁾ J Clin Oncol. 2024; 42: 2860-2872.
¹⁰⁾ J Clin Oncol. 2024; 42: 3000-3011.
¹¹⁾ J Clin Oncol. 2023; 41: 5363-5375.
¹²⁾ Cancer Res. 2022; 8: 130-141.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。