新薬承認情報
8ヶ月前
【新発売】レポトレクチニブ (オータイロ®)~ROS1融合遺伝子陽性NSCLCに対して~

ROS1阻害薬レポトレクチニブがROS1融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌に対して2024年9月に承認、 11月20日に薬価収載されました。 HOKUTOレジメンからその概要を紹介します。
薬剤情報
ROS1およびTRK阻害薬 レポトレクチニブ
*BMS株式会社の外部サイトへ遷移します
効能または効果
ROS1融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌
薬価
40mg1カプセル 3,468円
投与スケジュール
【1コース】連日内服
【催吐性】 軽度~最小度催吐性リスク*
【FN発症】TRIDENT-1試験で未報告
TRIDENT-1試験、添付文書の用法・用量
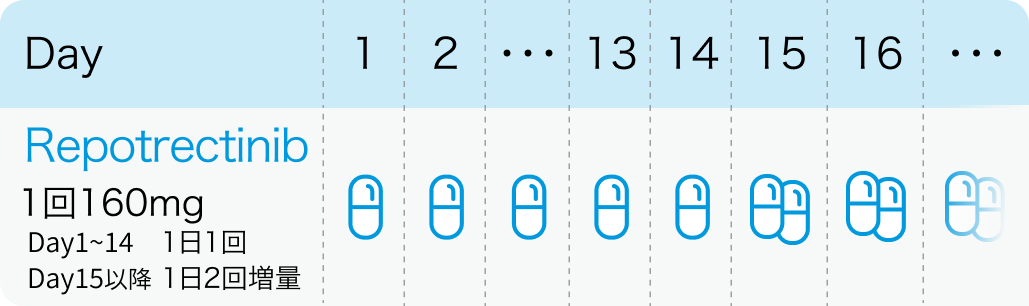
通常、 成人には1回160mgを1日1回14日間経口投与する。 その後、 1回160mgを1日2回経口投与する。 なお、 患者の状態により適宜減量する。
投与開始後14日間において忍容性が認められない場合には、 1日2回投与に増量しないこと
*NCCN Guidelines Version 2.2024 Antiemesisより
KeyData|臨床試験結果
📊 TRIDENT-1試験¹⁾
NSCLCを含むROS1、 NTRK1~3またはALKの遺伝子再構成を有する進行性固形がん患者を対象に、 Repotrectinibの安全性、 忍容性、 薬物動態、 抗腫瘍活性を評価する国際共同第1/2相臨床試験。 第2相の主要評価項目はORR。
【有効性】NSCLC患者
ROS1-TKI治療歴なし
- ORR : 79% (95%CI 68-88% 56/71例)
- mDOR : 34.1ヵ月 (95%CI 25.6ヵ月-未到達)
- mPFS : 35.7ヵ月 (95%CI 27.4ヵ月-未到達)
1種類のROS1-TKI治療歴あり/化学療法歴なし
- ORR : 38% (95%CI 25-52% 21/56例)
- mDOR : 14.8ヵ月 (95%CI 7.6ヵ月-未到達)
- mPFS : 9.0ヵ月 (95%CI 6.8ヵ月-未到達)
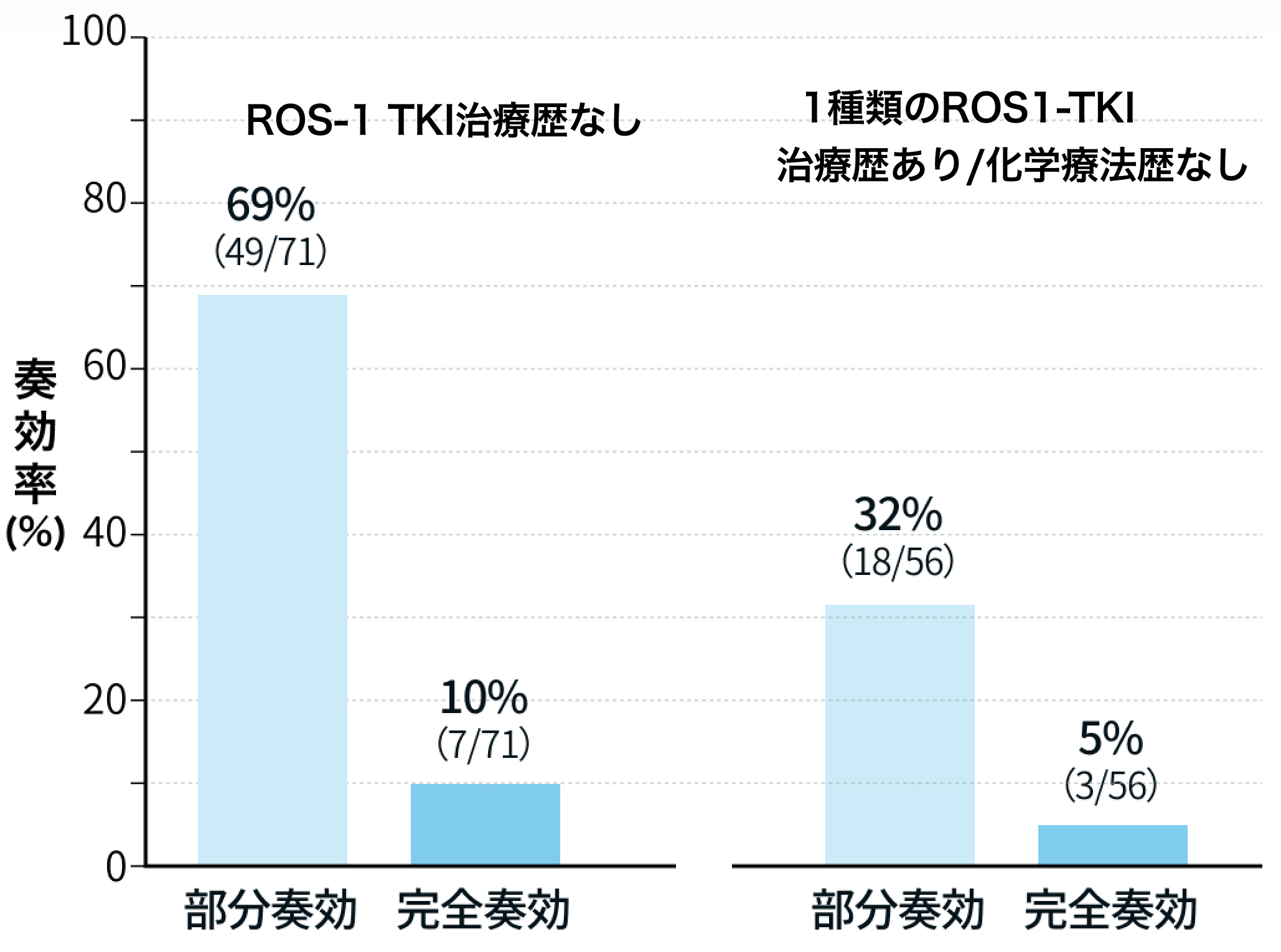
N Engl J Med. 2024 Jan 11;390(2):118-131²⁾より編集部作図
【安全性】有害事象 AE (カッコ内はGrade3~4)
- めまい 62.0% (2.6%)
- 味覚障害 52.6% (0%)
- 便秘 38.0% (0.2%)
- 貧血 37.6% (7.7%)
- 感覚異常 33.6% (0.7%)
- 呼吸困難 27.7% (6.3%)
- ALT増加 23.2% (1.9%)
- 倦怠感 22.3% (0.9%)
- 運動失調 21.1% (0.2%)
- AST増加 20.9% (2.1%)
- 悪心 20.0% (0.7%)
- 筋力低下 20.0% (1.9%)
- 頭痛 18.5% (0%)
- 血中CK上昇 17.6% (3.5%)
- 体重増加 15.7% (2.6%)
- 記憶障害 15.3% (0.2%)
- 咳 15.0% (0.2%)
N Engl J Med. 2024 Jan 11;390(2):118-131²⁾より引用
各プロトコル
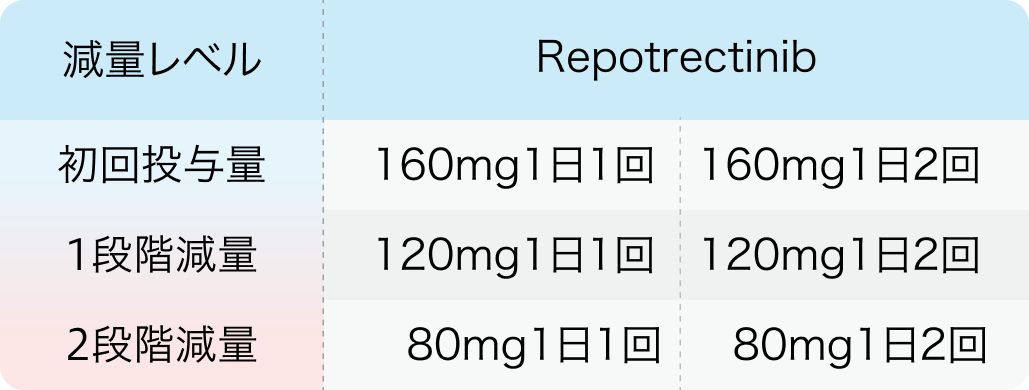
減量レベル
オータイロ®適正使用ガイド (2024年9月作成)より引用
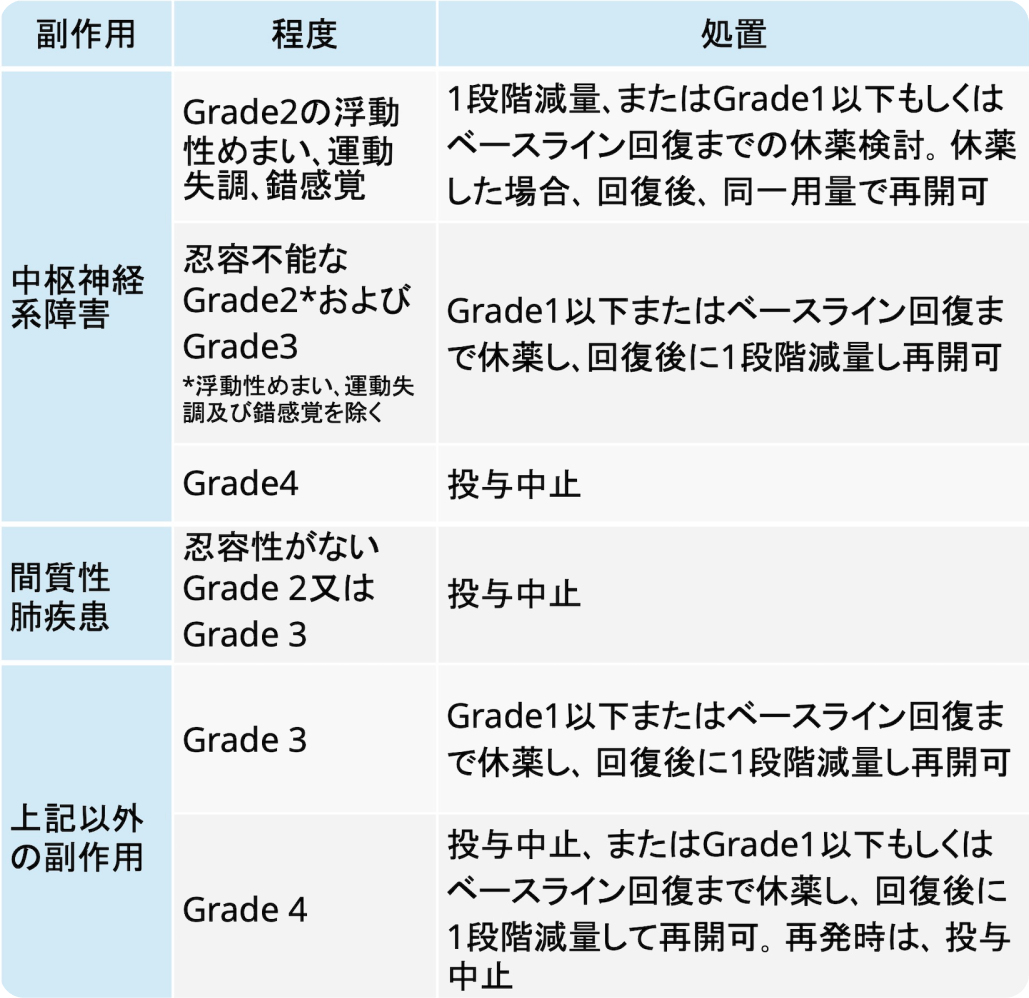
減量・休薬中止基準
オータイロ®適正使用ガイド (2024年9月作成)より引用
レジメンの特徴と注意点
レポトレクチニブは、 ROS1 G2032R耐性変異に対して有効性を示し、 頭蓋内奏効性も高い次世代のROS1 (およびTRK) -TKIである。 その安全性および有効性は、 第Ⅰ/Ⅱ相TRIDENT-1試験で報告されている。
遺伝子パネル検査・コンパニオン診断
NSCLCは肺がん全体の約85%を占め、 NSCLC患者の約1~2%が制御不能な細胞増殖をもたらすROS1遺伝子の変異を特徴とするROS1融合遺伝子陽性疾患とされる。
日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
注意すべき有害事象
レポトレクチニブの減量/中止に至った主な有害事象 (AE) として以下が報告されている。 安全性解析対象集団312例でおけるAEを理由とした減量率、中止率、 発症時期中央値は以下のとおり。
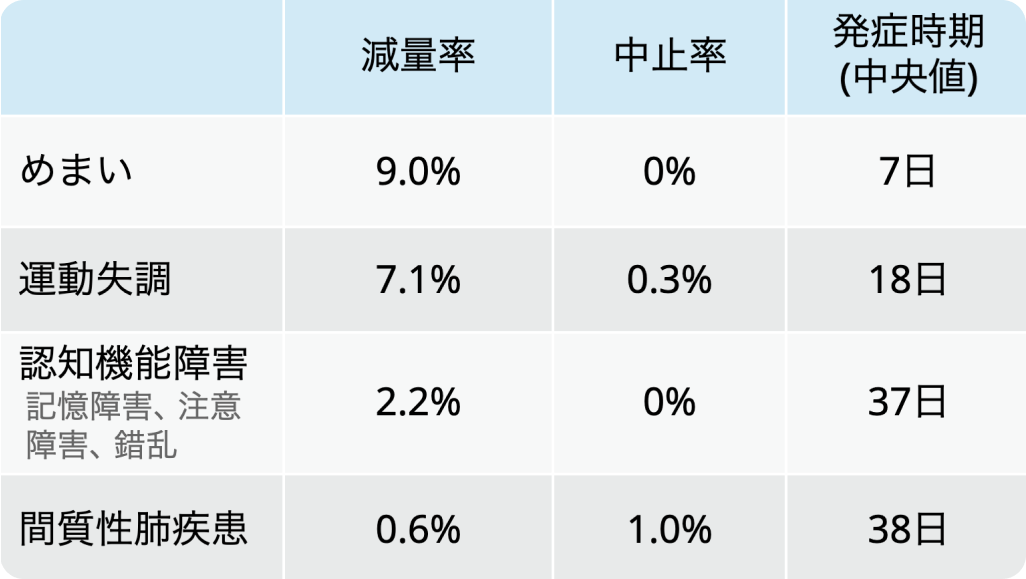
オータイロ®適正使用ガイド (2024年9月作成)より引用
肺癌診療ガイドライン2024の推奨⁵⁾
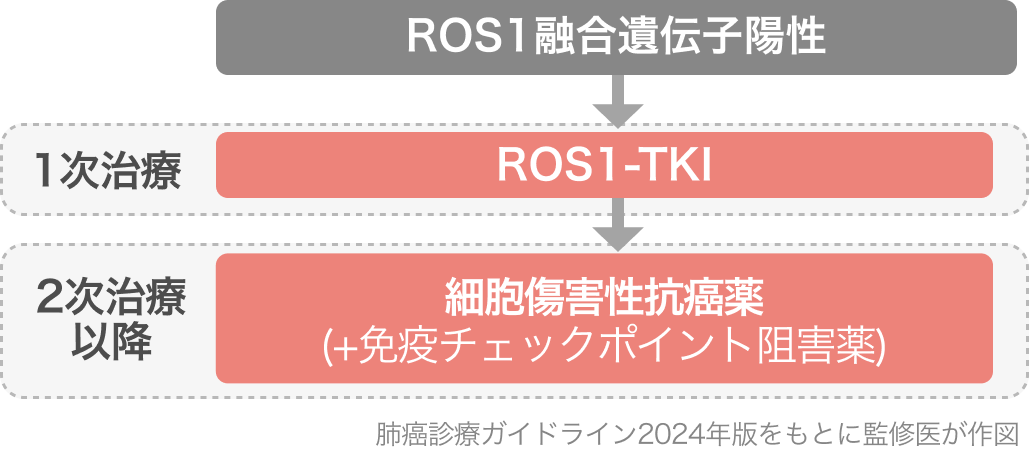
1次治療として、 ROS1-TKI単剤療法 (クリゾチニブ、 エヌトレクチニブ、 レポトレクチニブのいずれか) を行うよう強く推奨されている。
TRIDENT-1の結果と承認をもって、 本レジメンも2024年版から記載が追加されたが、 いずれも推奨とエビデンスの強さは横並びの1Cである。
- Repotrectinib (オータイロ®)
- Crizotinib (ザーコリ®︎)
- Entrectinib (ロズリートレク®︎)
参考文献
2) 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
関連コンテンツ
最新情報は、PMDA公式サイトでご確認ください
国立がん研究センター中央病院呼吸器内科医長 吉田達哉氏
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。