HOKUTO編集部
1ヶ月前
【最新解説】婦人科癌で注目されるADCは?

現在、 婦人科癌領域でも抗体薬物複合体 (antibody-drug conjugate; ADC) が開発されています。 注目されているADCについて解説いただきました (解説医師 : 東京慈恵会医科大学産婦人科学講座講師 西川忠曉先生)。
抗体薬物複合体 (ADC) とは
ADCは新たな薬物伝達システム (drug delivery system: DDS) を採用した薬剤であり、 その運搬を務める抗体薬、 抗体薬と薬剤と繋ぐリンカー、 ペイロードと呼ばれる薬剤 (主には殺細胞性抗癌薬) から構成される抗体医薬品である。
ADCの構成
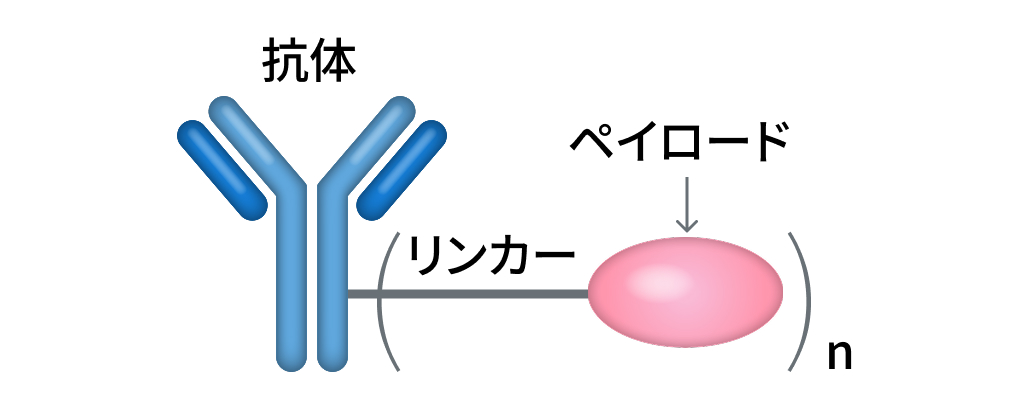
(編集部作成)
ADCの有効性
ADCの有効性は、 主に抗体薬の種類、 ペイロードそのものの性質、 抗体に結合するペイロードの数 (DAR)*¹、 リンカーの性質*²、 バイスタンダー効果*³、 抗体依存性細胞障害 (ADCC)*⁴などによるものと考えられている。
*¹drug-to-antibody ratio *²切断可能なものか否か
*³薬剤が、 標的細胞周囲の非標的細胞にも作用する現象
*⁴antibody-dependent cellular cytotoxicity。 抗体が標的細胞に結合し、 免疫細胞がこれを認識して標的細胞を破壊する現象。
DDSとは
DDSは、 薬剤を体内の目的の場所に効率よく届けるための送達技術を指す。 特にがん治療では、 癌組織に薬剤を選択的に届ける戦略として注目されている。
DDSによる薬物伝達方法
DDSによる薬物伝達方法には、 passive targeting (受動的ターゲティング) とactive targeting (能動的ターゲティング) の2つがある。
Passive targetingはEPR (enhanced permeability and retention) 効果と呼ばれる、 透過性が亢進した腫瘍血管からの薬剤漏出と、 リンパ系が未発達なためにその場に薬剤 (特に10~200nmの高分子) が留まる効果を利用した薬物伝達法である。
Active targetingは分子間の特異的結合能 (抗原抗体反応) を利用し、 薬剤を腫瘍へと運搬する薬物伝達法である。
抗体はサイズが約10nmであるため、 ADCはpassive targetingとactive targetingを併せ持つ抗体医薬品と考えられる。
ADC開発の歴史
DDSは1900年頃にドイツの細菌学者パウル・エールリヒ博士が提唱したMagic bullet theory (魔法の弾丸) が始まりとされる。
その後、 抗体を薬剤の運搬体とする発想が発展し、 1950年代にはメトトレキサートを抗体薬に結合させる研究が行われた。
2000年代に入ると、 抗CD20モノクローナル抗体であるリツキシマブ (2001年) や抗HER2モノクローナル抗体であるトラスツズマブ (2008年) が国内で承認され、 モノクローナル抗体技術は大きく前進した。 これらの技術の進展が、 ADCの実用化の土台となる。
そして2013年に、 トラスツズマブ エムタンシンがADCとして初めて国内で承認された。
婦人科癌領域で注目されるADC
上記の経緯を経て、 婦人科癌領域では注目されているADCが複数登場している。 以下に代表的な薬剤を示す。
チソツマブ ベドチン : TV
チソツマブ ベドチン (Tisotumab Vedotin) は、 抗tissue factor抗体であるチソツマブに切断可能なリンカーを介してペイロードであるベドチンが結合したADCである。
ベドチンはモノメチルアウリスタチンE (MMAE) とも呼ばれる微小管重合阻害薬であり、 チソツマブに対してDAR : 4という比で結合している。
臨床試験の結果
進行・再発子宮頸癌の2次治療以降を対象として実施された第Ⅲ相試験Innova TV301では、 単剤化学療法に比べてTVは死亡リスクを30%減少させることが報告された¹⁾。
特徴的な副作用
鼻出血などの出血、 ドライアイや結膜炎などの眼症状が知られており、 その治療中にはコンタクトレンズを使用しないこと、 ステロイド点眼液や人工涙点眼液を併用することなどが推奨されている。
ミルベツキシマブ ソラブタンシン : MIRV
ミルベツキシマブ ソラブタンシン (Mirvetuximab Soravtansine) は、 抗葉酸受容体α抗体であるミルベツキシマブに切断可能なリンカーを介してペイロードであるソラブタンシンが結合したADCである。
ソラブタンシンはDM4とも呼ばれる微小管重合阻害薬であり、 ミルベツキシマブに対してDAR : 3.5という比で結合している。
臨床試験の結果
葉酸受容体αの高発現を認めるプラチナ抵抗性卵巣漿液性癌を対象として実施された第Ⅲ相試験MIRASOLでは、 単剤化学療法に比べてMIRVは増悪リスクを35%減少させることが報告された²⁾。
さらに、 副次評価項目ではあるものの、 全生存期間を3.7ヵ月間ほど有意に延長させたことも報告されており、 プラチナ抵抗性卵巣癌においてOS延長を示した初の抗癌薬となった。
特徴的な副作用
ドライアイや結膜炎などの眼症状が知られており、 眼症状に対してはTVと同様のマネジメントが推奨されている。
トラスツズマブ デルクステカン : T-DXd
トラスツズマブ デルクステカン (Trastuzumab Deruxtecan) は抗HER2抗体薬であるトラスツズマブに切断可能なリンカーを介してペイロードであるデルクステカンが結合したADCである。
デルクステカンはトポイソメラーゼI阻害薬であるエキサテカンの誘導体で、 トラスツズマブに対してDAR : 8という比で結合している。
臨床試験の結果
胃癌や乳癌を対象に既に開発が進んでおり、 特に乳癌領域ではこれまでHER2陰性と考えられていた1+または2+/FISH陰性の低発現群 (low-HER2) でも有効であることが報告され、 脚光を浴びた³⁾。
また、 DSTINY-PanTumor02試験やHERALD試験といった第Ⅱ相バスケット試験では、 標準治療を終了した卵巣癌、 子宮頸癌、 子宮体癌の患者において、 T-DXdによる高い奏効率が報告されている⁴⁾⁵⁾。
さらに第Ⅱ相試験STATICEでは、 HER2:1+の子宮癌肉腫においても有効性が示唆され⁶⁾、 婦人科癌領域における今後の展開が期待されている。
特徴的な副作用
骨髄抑制や消化器症状などの副作用のほかに、 特徴的な副作用として間質性肺炎が知られており、 特に日本人では発症頻度が高いことが知られている。
サシツズマブ ゴビテカン : SG
サシツズマブ ゴビテカン (Sacituzumab Govitecan) は抗Trop-2抗体であるサシツズマブに切断可能なリンカーを介してペイロードであるゴビテカンが結合したADCである。
ゴビテカンはSN38とも呼ばれ、 トポイソメラーゼⅠ阻害薬であるイリノテカンの1,000倍の活性を持つとされる活性代謝物である。 サシツズマブに対してDAR : 7.6という高い比で結合しており、 乳癌領域で既に開発が進んでいる。
臨床試験の結果
TROPiCS-03試験は第Ⅱ相バスケット試験であり、 固形癌を対象としているが、 Trop-2の発現によらず治験参加が可能であった子宮体癌コホート (41例) における奏効率は22%で、 奏効期間の中央値は8.8ヵ月間であった⁶⁾。
特徴的な副作用
骨髄抑制や脱毛のほかに、 下痢が半数以上に認められており、 イリノテカンの活性代謝物をペイロードとしていることから、 UGT1A1の測定意義についても検討されている。
エキスパートはこう考える
婦人科癌領域において急速に開発が進むADCであるが、 今後は子宮頸癌に対するTV、 卵巣高異型度漿液性癌に対するMIRV、 子宮体癌に対するSG、 癌種横断的開発が進むT-DXdなどの臨床実装が期待される。
数多くのADCの臨床実装後には、 さまざまなコンパニオン診断薬の使い分け、 タンパク発現の把握、 ADCの投与順、 免疫チェックポイント阻害薬などとの併用療法、 特徴的副作用のマネジメントなど、 これまでに婦人科腫瘍診療医が経験したことのないような問題に対応することが求められる。
婦人科癌診療医はADCの特性を理解し、 適切な患者選択、 副作用管理、 薬剤耐性への対応など、 最新の知識を習得することが重要となる。
<出典>
1) N Engl J Med. 2024 Jul 4;391(1):44-55.
2) N Engl J Med. 2023 Dec 7;389(23):2162-2174.
3) N Engl J Med. 2022 Jul 7;387(1):9-20.
4) J Clin Oncol. 2024 Jan 1;42(1):47-58.
5) J Clin Oncol. 2024 Nov 10;42(32):3817-3825.
6) J Clin Oncol. 2024 Oct 10;42(29):3421-3429.

編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。