HOKUTO編集部
1年前
【注目KWD】PARP阻害薬タラゾパリブ : BRCA陽性乳癌への新しい治療選択

本特集では乳癌領域における注目キーワードについて解説していく。第1回となる今回は、PARP阻害薬タラゾパリブについて概説する(解説医師 : 神奈川県立がんセンター 乳腺外科部長 山下年成先生)
はじめに
タラゾパリブ (商品名ターゼナ) は、 2024年1月18日、 「癌化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能または再発乳癌」、 および同薬とアンドロゲン受容体拮抗薬エンザルタミドとの併用による 「BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌」 の治療薬として国内承認された。 本稿では、 乳癌におけるタラゾパリブの概要および承認の根拠となった臨床試験について解説する。
オラパリブとの比較
用法および用量は各薬剤で異なる
先に承認されているPARP阻害薬オラパリブとの処方面の違いは以下の2点である。
1,内服回数
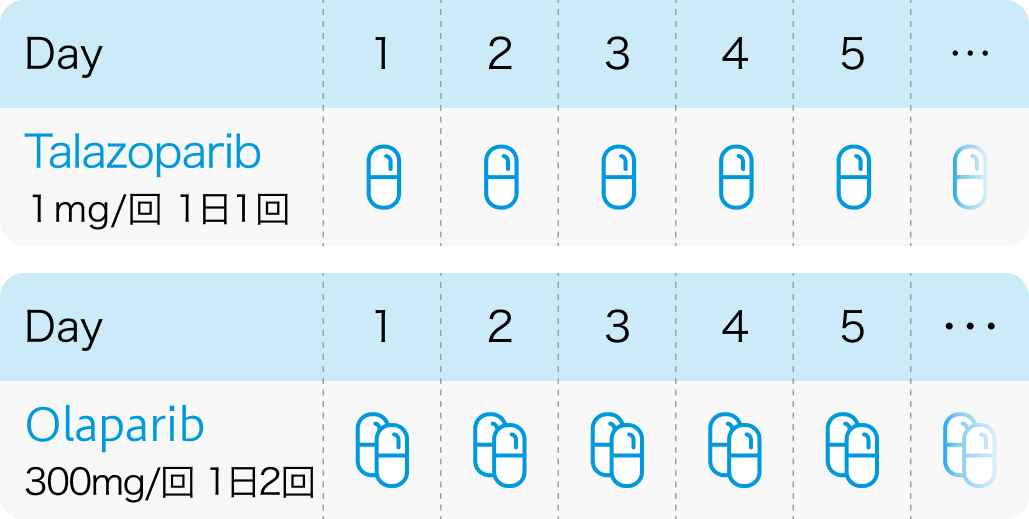
オラパリブが1日2回経口投与であるのに対し、 タラゾパリブは1日1回経口投与である。
2,減量の目安
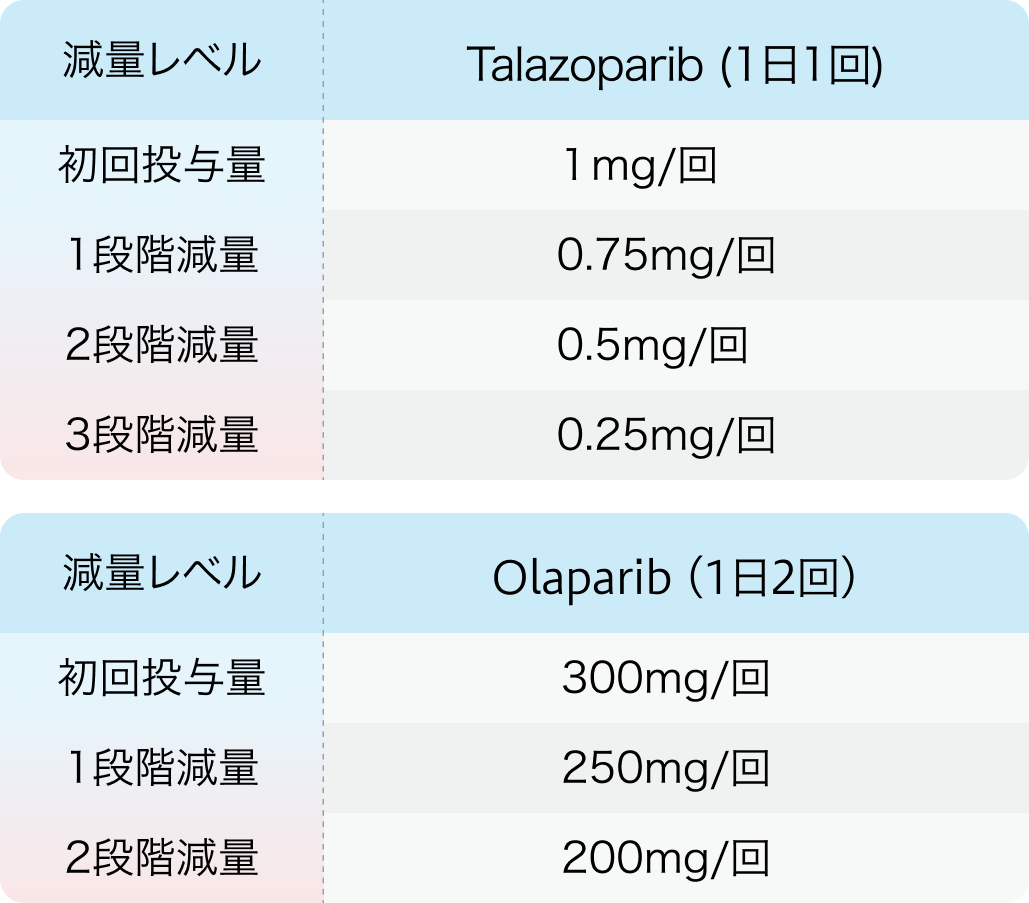
副作用の発現時にオラパリブは2段階まで減量が認められているのに対し、 タラゾパリブは3段階の減量まで認められている。
適応症例は治療歴とリスクで判断
オラパリブと医師選択薬剤を比較した試験では、 アントラサイクリン系、 タキサン系による既治療症例のみが対象だったのに対して、 EMBRACA試験ではアントラサイクリン系、 タキサン系のいずれかが使用されていれば適格とされていた。
そのため、 どちらかが使用されており、 かつもう一方の適応がない症例においては、 エビデンス的にはタラゾパリブの方が合致する。 一方、 オラパリブには高リスク例の術後治療としての適応がある。
有効性は比較困難もほぼ同等の結果
オラパリブとタラゾパリブの有効性に関する無作為化比較試験の実施例がないため比較は困難であるが、 どちらも医師選択薬剤に対するPFSのHRはほぼ同じであった (オラパリブのHR 0.58 [95% CI 0.43–0.80]、 p<0.001、 タラゾパリブのHR 0.54 [同0.41–0.71]、 p<0.001)。
安全性は嘔吐リスクがタラゾパリブでやや軽度
有害事象についても直接比較したデータはないが、 過去のデータでは、 タラゾパリブがオラパリブに比べて貧血が強く発現している¹⁾。 一方、 嘔気に関してはタラゾパリブがやや軽度で、 NCCNの制吐薬ガイドライン (Version1. 2024) において、 オラパリブはModerate to high emetic riskに分類されているが、 タラゾパリブはMinimal to low emetic riskに分類されている²⁾。
タラゾパリブの作用機序
他のPARP阻害薬に比べてトラッピング効果が強い
タラゾパリブはDNA一本鎖切断損傷を修復する酵素 「ポリ (ADP-リボース) ポリメラーゼ (PARP)」 を阻害する薬剤である。 また、 DNA二本鎖切断損傷を修復するBRCA遺伝子に変異がある場合は、 癌細胞に細胞死を誘導する作用がある。
PARP阻害薬の作用としては、 PARPをDNA損傷部位に結合したままにすることで、 DNA修復を阻害して細胞死に誘導する 「トラッピング効果」 が重要な役割を果たしていると考えられている。 タラゾパリブは他のPARP阻害薬に比べてこのトラッピング効果が強いことが基礎研究では示されている³⁾。
乳癌でのピボタル試験
第Ⅲ相EMBRACA試験
概要
EMBRACA試験は、 転移乳癌に対する化学療法歴があり、 生殖細胞系列のBRCA遺伝子変異がある局所進行または転移性乳癌患者を対象に、 タラゾパリブと化学療法単剤を比較した第Ⅲ相多施設共同非盲検無作為化比較試験である⁴⁾。
試験デザイン
431例が、 タラゾパリブ (1mg/日) 群もしくは担当医が選択した化学療法単剤 (カペシタビン、 エリブリン、 ゲムシタビン、 ビノレルビンのいずれか) による標準治療群に2 : 1で割り付けられた。
主要評価項目は盲検下独立中央評価 (BICR) による無増悪生存期間 (PFS) で、 副次的評価項目は客観的奏効率 (ORR)、 全生存期間 (OS)、 有害事象発生割合などだった。
有効性に関する結果
タラゾパリブ群は標準治療群に比べて有意にPFS中央値を延長した (8.6ヵ月vs 5.6ヵ月、 ハザード比[HR] 0.54、 95%CI 0.41-0.71、 p<0.001)。 OS中間解析では、 死亡HR中央値は0.76 (95%CI 0.55-1.06、 p=0.11) だった。 ORRは、 タラゾパリブ群が標準治療群より高値であった (62.6% vs 27.2%、 p<0.001)。
安全性に関する結果
Grade3-4の血液学的有害事象 (主に貧血) は、 タラゾパリブ群で55%、 標準治療群で38%に発現した。 投与中止に至った有害事象は、 タラゾパリブ投与群で5.9%、 標準治療群で8.7%に発現した。 減量または中断に至る有害事象はタラゾパリブ投与群の66%、 標準治療群の60%で発現した。
減量または中断の原因となった有害事象は、 タラゾパリブ投与群では貧血、 好中球減少症、 血小板減少症などであり、 標準治療群では好中球減少症、 手足症候群、 悪心、 下痢などであった。
患者報告アウトカムに関する結果
EORTC QLQ-C30におけるGHS/QoL尺度のベースラインからの推定全平均変化量は、 標準治療群で有意な悪化がみられたのに対し、 タラゾパリブ群では有意な改善がみられた (3.0 [95% CI 1.2-4.8] vs -5.4 [-8.8~-2.0]、 p<0.001)。 標準治療と比較して、 タラゾパリブによる治療では、 GHS/QoL尺度による臨床的に意味のある悪化の発現が有意に遅延した。
さらに、 乳房症状に関する尺度 (EORTC QLQ-BR23) のベースラインからの推定全体平均変化量において、 標準治療群では有意な変化がみられなかったのに対し、 タラゾパリブ群では有意な改善がみられた (-5.1 [95%CI -6.7~-3.5] vs -0.1 [95%CI -2.9~2.6]、 p=0.002) ⁵⁾。
国内第Ⅰ相試験
概要
日本人進行固形癌患者を対象にした国内第Ⅰ相試験 (C3441030試験) は、 用量漸増パートと拡大パートの2パートで構成され、 拡大パートでは癌化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能または再発乳癌患者19例が登録された⁶⁾。
試験デザイン
主な選択基準は、 20歳以上の女性または男性であったこと以外は、 上述のEMBRACA試験とほぼ同じだった。 適格患者には、 各28日間サイクルの初日から、 推奨用量 (1mg/日) のタラゾパリブが投与された。 中等度の腎機能障害 (クレアチニンクリアランス30~59mL/分) を有する例では、 1段階減量の0.75mg/日を開始用量とした。
主要評価項目は担当医判定による確定客観的奏効率 (確定ORR) で、 副次評価項目は盲検化された独立中央審査 (BICR) 判定による確定ORRおよび確定病勢コントロール (確定DC)、 担当医判定による奏効までの期間 (TTR) とPFS、 OS、 安全性 (有害事象) 等だった。
有効性に関する結果
タラゾパリブに対する担当医判定による確定ORRは57.9% (11/19例、 90%CI 36.8-77.0%) であり、 臨床的に意義のある抗腫瘍活性を示したが、 完全奏効を示した患者はいなかった。 病勢安定は36.8% (7/19例) に認められ、 5.3% (1/19例) に病勢進行が認められた。
PFS中央値は7.2ヵ月 (95%CI 4.1ヵ月-推定不能[NE]) で、 奏効期間のKaplan-Meier推定中央値は6.8ヵ月 (95%CI 2.7ヵ月-NE) だった。
安全性に関する結果
19例全例に治療関連有害事象が認められ、 Grade3または4の治療関連有害事象発現率は52.6% (10/19) だった。
タラゾパリブ投与中断に至った有害事象は42.1%に発現し、 多く見られたのは貧血 (31.6%)、 好中球数減少 (10.5%)、 呼吸困難 (5.3%)、 頭痛 (5.3%) などだった。
最も一般的な血液学的有害事象は貧血で、 患者の68.4%に発現した。 Grade3の貧血は47.4%に認められたが、 Grade4以上の貧血は認められなかった。 好中球減少は63.2%に発生し、 そのうちGrade3に該当したのは4例で、 Grade4以上は認められなかった。
解説医師

出典
¹⁾ JAMA Oncol. 2024 May 1;10(5):658-670.
²⁾ NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Antiemesis(Version 1.2024)
³⁾ Mol Cancer Ther. 2014 Feb;13(2):433-43.
⁴⁾ N Engl J Med. 2018 Aug 23;379(8):753-763.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。