HOKUTO編集部
8ヶ月前
【EHA 2025】多発性骨髄腫の注目3演題を解説

2025年6月にイタリア・ミラノで開催された欧州血液学会 (EHA 2025) において発表された多発性骨髄腫(MM)領域の3演題について、 大阪国際がんセンター血液内科副部長の藤重夫先生にご解説いただきました。
第Ⅱ相iMMagine-1試験
再発・難治例への新規CAR-T細胞療法anito-cel
再発・難治性 (R/R) MMに対するB細胞成熟抗原 (BCMA) を標的とした新規自家CAR-T細胞療法 「anitocabtagene autoleucel (anito-cel) 」 の第Ⅱ相試験iMMagine-1の最新結果が報告された。
anito-celが既存のCAR-T細胞療法と異なる点は、 従来の抗体scFvではなく、 よりシンプルで安定性と親和性に優れた新規結合体D-domainを用いて設計されていることである。 D-domainは、 T細胞の活性化による過剰なサイトカイン産生などの副作用を抑えつつ、 高い抗腫瘍効果を発揮できるよう構造に工夫が凝らされているため、 他の標的に対するCAR-T細胞療法においても応用可能ではないかと感じた。
主要評価項目はIMWG基準に基づくORR
本試験では、 3レジメン以上の治療歴があり、 直近の治療に対して難治性を示した18歳以上のR/R MM患者が対象とされた。 製造後、 患者には前処置としてリンパ球除去化学療法を行い、 115×10⁶個のanito-cel を単回投与した。 主要評価項目は国際骨髄腫作業部会 (IMWG) 基準に基づくORRであった。
ORRは97%、 CR率も62%と高率
患者の86%が3剤耐性、 43%が5剤耐性であったにもかかわらず、 ORRは97%、 完全奏効または厳密完全奏効 (CR/sCR) 率は62%と非常に高かった。 微小残存病変 (MRD) 評価が可能であった58例中54例 (93.1%) が10⁻⁵以下で陰性化を達成していた。 さらに12ヵ月時点での奏効期間、 無増悪生存期間 (PFS)、 OS率は、 それぞれ75.6%、 78.5%、 96.5%と良好であり、 PFS中央値も1年を大きく超えることが予想される。
安全性については98例が評価対象とされ、 Grade 3以上のAEは好中球減少 (54%)、 貧血 (22%)、 血小板減少 (20%) などの血球減少が主であった。 サイトカイン放出症候群 (CRS) は83%に認められたが、 その大半がGrade 1で、 98%が14日以内に回復した。 神経毒性 (ICANS) は9%に認められたが重篤例は少なく、 遅発性神経毒性やパーキンソニズム、 ギラン・バレー症候群などは1例も報告されていなかった。
D-domainは他のCAR-T細胞療法の開発にも応用可能か
anito-celは多剤抵抗性を有するR/R MMにおいて、 追跡期間はまだ短いものの深く持続的な奏効と管理可能な安全性を示しており、 今後の追跡データが期待される。 anito-celの第Ⅲ相試験が既に計画されており、 その結果にも注目したい。 特にD-domainを用いたキメラ抗原受容体 (CAR) 構造は、 今後、 他の抗原を標的としたCAR-T細胞療法の開発にも影響を与える革新的技術となる可能性を秘めている。
>>詳細を確認する
(EHA 2025公式サイトに遷移)
第Ⅲ相IRAKLIA試験
R/R MMへのIsa併用、 静注 vs 皮下
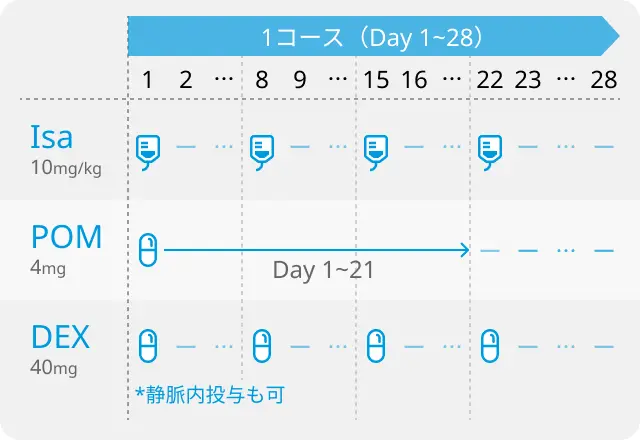
R/R MMに対する抗CD38抗体イサツキシマブ (Isa) 静脈投与 (IV) +ポマリドミド+デキサメタゾン (Pd) 併用療法 (Isa-Pd) は、 第Ⅲ相ICARIA-MM試験の結果に基づき、 日本も含めて世界的に承認されている。
一方、 新たに開発された皮下投与型のオンボディ・インジェクター (OBI) は、 Isaの定量投与が短時間かつ低容量で可能となる持続注入型のウェアラブルデバイス (以下、 Isa OBI) であり、 患者の利便性と治療施設での効率向上が期待されている。 既に第Ib相試験では、 Isa OBIの安全性と薬物動態プロファイルも含めた有効性が確認されており、 第Ⅲ相IRAKLIA試験では、 Isa OBI+Pdと従来のIsa IV+Pdの比較が行われた。
主要評価項目はORRとIsaトラフ濃度
IRAKLIA試験では、 1ライン以上の治療歴を有するR/R MM患者531例が、 Isa OBI (1,400mg) 群 (263例) とIsa IV (10mg/kg) 群 (268例) に1:1で無作為に割り付けられた。 治療はいずれも4週1サイクルで、 Isaは第1サイクルでは毎週、 以降は隔週投与、 ポマリドミドは1-21日、 デキサメタゾンは週1回 (75歳以上は半量) 投与された。 主要評価項目は、 ORRおよび第6サイクル1日目におけるIsaのトラフ濃度 (Ctrough) であった。
ORRは両群とも約7割、 皮下投与は静注投与に非劣性
中間解析時点での追跡期間中央値は12ヵ月であり、 ORRはIsa OBI群で71.1%、 Isa IV群で70.5%と両群同等で、 事前に設定された非劣性マージン (0.839) を満たした。
トラフ濃度 (Ctrough) もIsa OBI群で高値 (平均499μg/mL) を示し、 Isa IV群 (340μg/mL) に対して有意に非劣性が確認された。 Grade 3以上のAEの発現はIsa OBI群で81.7%、 Isa IV群で76.1%に認められ、 治療中止率は両群とも約8%と低率であった。 注射部位反応はIsa OBI群で11例 (4.2%、 全例Grade 1–2) に限定され、 全体の99.9%のSC投与が中断なく完遂された。 患者満足度においてもIsa OBI群が優れる傾向がみられた。
有望な治療選択肢だが、 固定用量の影響にはフォローが必要
以上より、 Isa OBIが従来のIV投与に対し、 有効性・薬物動態・安全性の面で非劣性であり、 患者利便性の観点からも有望な治療選択肢となる可能性が示された。 ただしIsa OBIは固定用量のため、 体重の軽い患者が多い日本では従来の体重換算投与よりも高用量となる可能性があり、 その影響についてはフォローが必要である。
本デバイスは、 治療の簡便化と患者中心のケア向上を目指す今後のMM治療の新たな一歩といえるが、 他の抗体薬の投与にも展開されることを期待したい。
>>詳細を確認する
(EHA 2025公式サイトに遷移)
第Ⅱ相RedirecTT-1試験
MM髄外病変へのトアルクエタマブ+テクリスタマブ
MMにおける髄外病変 (EMD) は、 標準治療に対する奏効率が低く、 再発も早いため、 極めて予後不良とされている。 プロテアソーム阻害薬、 免疫調整薬、 抗CD38抗体など従来の抗MM治療では効果が限定的であり、 新たな治療選択肢が求められている。 第Ⅱ相RedirecTT-1試験では、 抗GPRC5D/BCMA二重特異性抗体トアルクエタマブ (Tal) +抗BCMA/CD3二重特異性抗体テクリスタマブ (Tec) 併用療法 (Tal+Tec) の有効性を評価した。
対象はトリプルクラス暴露のR/R MM
対象は、 プロテアソーム阻害薬、 免疫調整薬、 抗CD38モノクローナル抗体の3種類の治療歴を有する (トリプルクラス暴露 : TCE) R/R MMでEMDを有する患者90例であった。 Tal (0.8 mg/kg) +Tec (3.0 mg/kg) を隔週投与し、 奏効後には月1回への減量も許容された。
対象患者の39%は非分泌型・乏分泌型、 かつ2つ以上のEMD病変 (中央値2ヵ所) を有し、 84%が3剤併用療法耐性、 36%が5剤併用療法耐性、 20%が抗BCMA CAR-T治療歴を持つ高リスク群であった。
全体のORRは79%、 CR以上も52%
追跡期間中央値12.6ヵ月におけるORRは79%、 うちCR以上は52%と高く、 CAR-T細胞療法歴を有する患者においてもORRは83%と良好であった。 9ヵ月時点での奏効持続期間 (DOR)、 PFS率、 OS率はそれぞれ75%、 64%、 80%であり、 従来治療や二重特異性抗体単剤療法に比して高い効果が示された。
AEは、 CRSが78% (全例Grade 1–2)、 ICANSが12% (Grade 3以上が2例) に認められた。 演者は安全性を強調していたものの、 死亡に至った例 (Grade 5 AE) が10%程度と高い点には注意を要すると考えられる。 特に半分は感染症と報告され、 感染症管理が重要である。
感染症による死亡に注意が必要も、 有望な治療選択肢
以上から、 EMDを有する再発・難治性MMにおけるTal+Tecの有望な治療効果と管理可能な安全性プロファイルが示された。 単純比較は難しいものの、 二重特異性抗体併用療法でCAR-T療法に遜色ない効果を得られる可能性がある。 ただし、 費用面でもCAR-T細胞療法と同等になる可能性がある。
>>詳細を確認する
(EHA 2025公式サイトに遷移)
解説医師

関連コンテンツ
イサツキシマブ、 ポマリドミド、 デキサメタゾン > 再発難治性
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。