IBDマニュアル
2年前
【IBDマニュアル】生物学的製剤の1次無効、 2次無効

本コンテンツでは原因不明で治療が困難な炎症性腸疾患 (IBD) について、 疫学・病態・治療などの観点から解説を行います。 最新のエビデンスを基にしておりますので、 ぜひ臨床の参考としていただければ幸いです。
執筆 : 東山正明先生、 穂苅量太先生
防衛医科大学 消化器内科
薬物治療における1次無効・2次無効
本邦では2002年にクローン病の先進的治療 (advanced therapy) として抗TNFα製剤であるインフリキシマブが承認されて以降、 各種の生物学的製剤 (抗インテグリン製剤、 抗IL-12/23・IL-23製剤) とJAK阻害薬が使用可能となっている。
生物学的製剤・JAK阻害薬は入院率・手術率を減少させ、 炎症性腸疾患 (IBD) の内科治療の中心的な役割を担っているが、 残念ながら治療に反応しない1次無効 (primary non-response ; PNR) 症例が一定数存在する。
また、 寛解導入には至ったものの維持療法中に効果が減弱する現象が2次無効 (loss of response ; LOR) で、 薬剤の増量や投与間隔の短縮あるいは他剤へのスイッチを考慮する必要が出てくる。 特に生物学的製剤は免疫原性を持つゆえの2次無効は理論的に不可避と言われているが、 新型製剤ではそれを最小限にするために作製方法に工夫がなされている。
1次無効
臨床的には寛解導入の治療で臨床所見や臨床症状の改善がないことをPNRと定義することが一般的に受け入れられているが¹⁾、 PNRにコンセンサスが得られている一致した定義はなく、 同じ薬剤でも臨床試験毎に評価する時期や治療反応性の定義が異なり、 一貫性のある議論が難しいことが多々ある。
例えば、 ACCENT Ⅰ studyとACCENT Ⅱ studyでは、 インフリキシマブのPNRの評価時期がそれぞれ投与2週と10~14週で²⁾、 インフリキシマブひとつをとってもPNRが10~30%と異なる¹⁾。 またPNRの要因として、 発症から2年以上経過、 小腸病変の存在、 喫煙、 C反応蛋白 (CRP) 正常、 アポトーシス関連の遺伝子変異(FAS-Lやcaspase 9)などが報告されており²⁾、 対象患者によっても大きく異なることが予想される。
さらに異なる薬剤間では1次無効率の比較は困難となり、 重症度、 投与経路、 作用機序、 副作用、 年齢、 性別、 即効性なども加味して選択する。
2次無効
一般的に寛解導入後の寛解維持治療への反応が無くなることをLORと呼ぶが、 コンセンサスが得られた一致した定義はない¹⁾。
多くの臨床試験では臨床症状の指標 (クローン病ではCDAI、 潰瘍性大腸炎ではMayo Score) を用いて治療反応性と寛解を定義しているが、 例えば症状悪化の際の生物学的製剤の増量をLORに含めて評価する報告と、 増量はLORに含めずに生物学的製剤の中止、 他剤へのスイッチ、 外科治療に至った症例をLORとする報告があり、 評価には注意が必要である³⁾。
また、 症状再燃の原因が活動性炎症か見極める必要がある。 例えば、 小腸病変の繊維化狭窄、 過敏性腸症候群、 癌、 食事、 アミロイドーシス、 小腸内細菌異常増殖症、 胆汁性下痢、 感染、 虚血性腸炎などがIBDの症状悪化と判断されてしまうこともあり得る²⁾。
LORの病態には血中トラフ濃度依存性と非依存性が想定されており、 さらに血中トラフ濃度依存性には抗薬物抗体依存と非依存がある。
血中トラフ濃度依存性2次無効
基本的に維持療法の有効性は血中トラフ濃度に依存し、 インフリキシマブの場合1μg/mL以上の症例で有効性が高く、 血中トラフ濃度の低下により効果が減少する⁴⁾。
インフリキシマブの血中濃度低下の原因として最も知られているのが、 抗薬物抗体の出現である。 インフリキシマブはマウス・ヒトのキメラ型IgG1抗体で免疫原性が高いため、 抗薬物抗体が産生されやすいと考えられている⁵⁾。 その後開発されたファージディスプレイ法で作製されたヒト型抗体であるアダリムマブでも抗薬物抗体は検出されるが低率であり、 同じく抗TNFα製剤でトランスジェニック法により作製されたヒト型抗体であるゴリムマブではさらに検出率が低率となっている (図1) ⁶⁾。
抗薬物抗体出現率
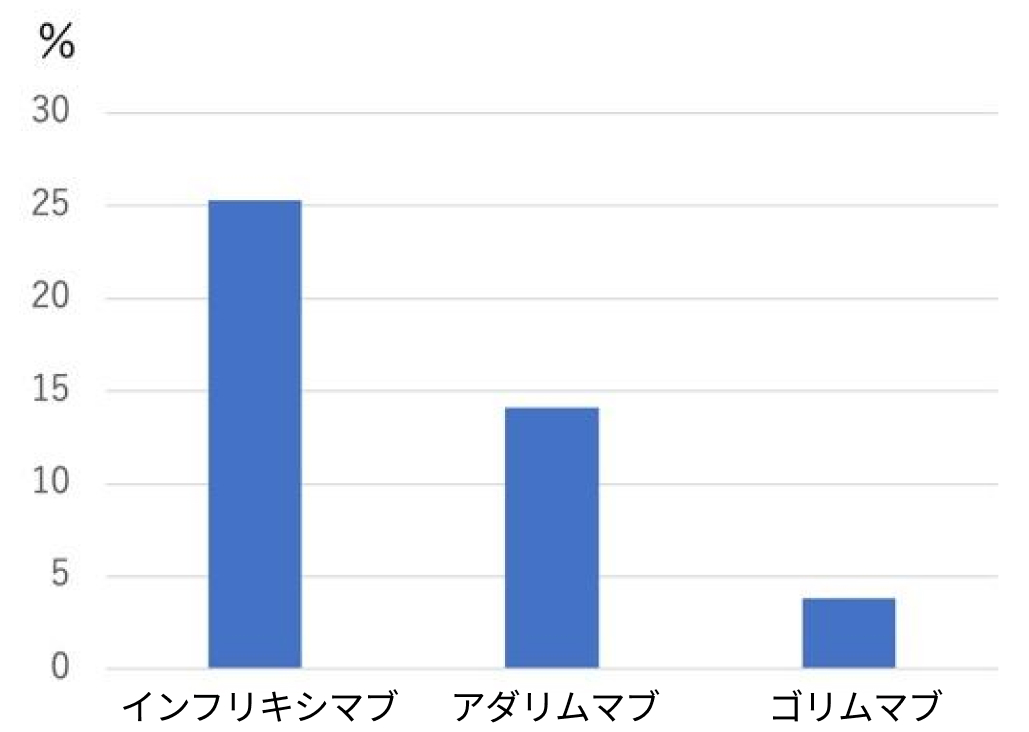
筆者作成
その他、 免疫複合体の形成や投与経路 (皮下注射より静脈注射で免疫原性が低い)、 他剤での抗薬物抗体産生歴に加え⁷⁾、 遺伝子多型が抗薬物抗体発生要因として報告されている。
欧米では人口の40%に認めるHLA-DQA1*05の遺伝子多型と抗薬物抗体との関連が報告され⁸⁾、 日本のCD患者における検討では、 IL-17F (rs766748)、 TRAF3IP2 (rs1883136)、 TNFα-857 C>T (rs1799724) の遺伝子多型がインフリキシマブの抗薬物抗体発生に関与していると報告されている⁹⁾¹⁰⁾。
その他の生物学的製剤についてもLORの原因に遺伝子多型の関与が示唆されるが、 今後の報告が待たれる。 また、 IgG1抗体の血中半減期は21日と長く、 これは胎児性Fc受容体(FcRn)との結合に依るところが大きいが、 FcRnに遺伝子変異があると結合親和性が低下し、 分解が促進され血中濃度が低下するため、 FcRnの遺伝子変異は抗薬物抗体非依存性LORの一因と考えられる¹¹⁾。
血中トラフ濃度非依存性2次無効
血中トラフ濃度は保たれているにも関わらずLORとなる症例も認めており、 その原因として病態の変化が考えられている。
潰瘍性大腸炎患者では、 発症早期はTh1とTh17関連のサイトカインが病態に関与しているが、 10年ほど経過するとTh1からTh2にシフトするため、 治療標的となっていないサイトカインが上昇することでLORとなる可能性が示唆される¹²⁾。
生物学的製剤の2次無効率
抗TNFα製剤開始12ヵ月後のLORは薬剤増量例もLORに含めるとクローン病で23~46%だが、 薬剤中止例のみでは7~25%になる²⁾。
最近の系統的レビューによると、 寛解導入後から平均52週の観察期間による寛解維持率は抗TNFα抗体で72.6%、 抗インテグリン抗体で51.8%、 抗IL-12/23・IL-23抗体で67.6%であるとされている¹³⁾。
上記で説明した理由により、 これらの数字を薬剤間で単純比較することはできず、 また有害事象や前治療の影響を正確に除外できないが、 いずれの薬剤も20~30%程度の2次無効率と推定される。
2次無効例に対する対策
インフリキシマブとアダリムマブ投与中のLORでは、 投与間隔の短縮・増量が保険適用となっており効果が期待される。 またインフリキシマブの2次無効を予防するためのアザチオプリン併用については潰瘍性大腸炎、 クローン病ともに有効性が報告され¹⁴⁾、 抗薬物抗体産生を減少させることが一因と考えられている。
アダリムマブとアザチオプリンの併用についてはクローン病の内視鏡的改善率を有意に上昇させたが、 寛解維持効果に差はなかった¹⁵⁾。 抗インテグリン抗体、 抗IL-12/23抗体ではアザチオプリン併用の有効性はないと考えられている¹⁵⁾。
出典
- Loss of Response to Anti-TNFs: Definition, Epidemiology, and Management. Clin Transl Gastroenterol. 2016 Jan 7;7(1):e135. PMID: 26741065
- Optimizing anti-TNF treatments in inflammatory bowel disease. Autoimmun Rev. 2014 Jan;13(1):24-30. PMID: 23792214
- Review article: loss of response to anti-TNF treatments in Crohn's disease. Aliment Pharmacol Ther. 2011 May;33(9):987-95. PMID: 21366636
- Retrieval of serum infliximab level by shortening the maintenance infusion interval is correlated with clinical efficacy in Crohn's disease. Inflamm Bowel Dis. 2012 Aug;18(8):1480-7. PMID: 21987418
- Monitoring functional serum antitumor necrosis factor antibody level in Crohn's disease patients who maintained and those who lost response to anti-TNF. Inflamm Bowel Dis. 2010 Nov;16(11):1898-904. PMID: 20310016
- Comparative Immunogenicity of TNF Inhibitors: Impact on Clinical Efficacy and Tolerability in the Management of Autoimmune Diseases. A Systematic Review and Meta-Analysis. BioDrugs. 2015 Aug;29(4):241-58. PMID: 26280210
- Immunogenicity of Biologics in Chronic Inflammatory Diseases: A Systematic Review. BioDrugs. 2017 Aug;31(4):299-316. PMID: 28612180
- HLA-DQA1∗05 Genotype and Immunogenicity to Tumor Necrosis Factor-α Antagonists: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2023 Nov;21(12):3019-3029.e5. PMID: 37061107
- Factors predicting the therapeutic response to infliximab during maintenance therapy in Japanese patients with Crohn's disease. PLoS One. 2018 Oct 4;13(10):e0204632. PMID: 30286108
- Genetic Polymorphisms of IL-17F and TRAF3IP2 Could Be Predictive Factors of the Long-Term Effect of Infliximab against Crohn's Disease. Biomed Res Int. 2015:2015:416838. PMID: 26558270
- A Genetic Variation in the Neonatal Fc-Receptor Affects Anti-TNF Drug Concentrations in Inflammatory Bowel Disease. Am J Gastroenterol. 2016 Oct;111(10):1438-1445. PMID: 27481307
- The influence of cytokines on the complex pathology of ulcerative colitis. Autoimmun Rev. 2022 Mar;21(3):103017. PMID: 34902606
- Early Remission With Induction Therapy Predicts Long-Term Remission in Inflammatory Bowel Diseases: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2023 Nov 1;118(11):2084-2087. PMID: 37207296
- Immunomodulator and Biologic Combination Therapy in IBD: The Debate That Just Won't Go Away?. J Crohns Colitis. 2020 Oct 5;14(10):1343-1344. PMID: 33016315
- Combination therapy in inflammatory bowel disease: Current evidence and perspectives. Int Immunopharmacol. 2023 Jan:114:109545.PMID: 36508920
関連コンテンツ
クローン病の重症度分類
潰瘍性大腸炎の重症度分類
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。